Интересное сегодня
Как мозг регулирует стресс и поведение: открытие ключевого ц...
Прорыв в понимании мозга: обнаружен ключевой регулятор стресса и поведения Новое исследование Калиф...
Временная Прикладная Психология: Как Собственность Времени У...
Введение В условиях современного общества, ориентированного на производительность, умение находить в...
Психологическое состояние и стратегии преодоления у медицинс...
ВведениеВойны оказывают разрушительное воздействие на все стороны конфликта, приводя к гибели, травм...
Когнитивная нагрузка при переключении между эгоцентрическими...
Введение В повседневной жизни мы постоянно переключаемся между эгоцентрическими (основанными на теле...
Как достичь счастья: научный подход и факторы влияния
Феномен счастья в современном мире Счастье - это универсальная ценность, которую человечество ищет н...
Как любить партнера-человека, который склонен к излишним раз...
Любовь к партнеру, который склонен к излишним размышлениям Если вы находитесь в отношениях с человек...
Дефицит временной обработки зрительной информации при постконтузионном синдроме
Гиперестезия движения при постконтузионном синдроме (ПКС) является распространенным последствием легкой черепно-мозговой травмы (ЧМТ). Данное исследование изучило, изменяет ли ПКС пороговые значения временного разрешения зрительного восприятия в психофизических измерениях, поддерживающих обнаружение движения.
Пятнадцать пациентов с ПКС и пятнадцать контрольных лиц соответствующего возраста прошли оценку пороговых значений критической частоты мельканий (КЧМ) на разных эксцентриситетах полей зрения. Обобщенная линейная смешанная модель была использована для проверки различий между группами пороговых значений КЧМ, рассматривая эксцентриситет как повторяющийся фактор и включая вариабельность КЧМ в качестве ковариаты. Измерение зрачков и контрольные пробы использовались для контроля усталости и бдительности. Непараметрические корреляции оценивали взаимосвязи между временем, прошедшим с момента травмы, тяжестью симптомов и показателями КЧМ.
Результаты показали, что вариабельность КЧМ значительно в большей степени повышает пороговые значения КЧМ в группе ПКС по сравнению с контрольной группой. Отсутствие значительных различий в вариабельности КЧМ между группами и модуляция эксцентриситетом предполагают, что перцептивный шум сильнее влияет на общую временную зрительную чувствительность при ПКС. Дни с момента травмы отрицательно коррелировали с вариабельностью, указывая на компенсаторную стабилизацию временной чувствительности со временем. Тяжесть симптомов не коррелировала с показателями КЧМ.
В заключение, гиперестезия движения при ПКС может отражать нарушения в параметрах временной обработки зрительной информации, потенциально связанные с измененным внутренним нейронным шумом. Несмотря на некоторую рекалибровку после травмы, сохраняющиеся аномалии подчеркивают необходимость дальнейших исследований ранних клинических вмешательств, направленных на перцептивный шум.
Введение
Визуальная гиперестезия движения является распространенным последствием легкой черепной травмы, причем до 90% пострадавших сообщают о таких симптомах. Острое лежащее в основе нарушение включает растяжение аксолеммы и электрохимический дисбаланс, преимущественно затрагивающий сильно миелинизированные пути, простирающиеся от подкорковых до лобных и затылочно-теменных областей. Эти диффузные нарушения создают основу для сложного профиля симптомов, варьирующихся от когнитивных нарушений до мультисенсорной дисфункции. Хотя гиперестезия движения часто сопутствует функциональным вестибулярным расстройствам, структурные изменения вестибулярного аппарата наблюдаются не всегда. Вместо этого проявления симптомов кажутся более тесно связанными с гиперреактивностью в кортикальных сетях зрительной обработки и нарушенной зрительной модуляцией вестибулярных и окуломоторных центров управления.
Исторически мультисенсорная зрительно-вестибулярная интеграция у лиц с сотрясением мозга и гиперестезией движения предполагалась на основе оценки постуральной устойчивости и окуломоторных прокси. Хотя эти подходы экологически валидны и отражают перцептивные нарушения, они ограничены в своей способности точно определять специфические дисфункциональные узлы в распределенной многостадийной сети обработки сенсорной информации. Следовательно, такие методы предоставляют широкую оценку, но не позволяют отделить дискретный вклад зрительного восприятия, мультисенсорной интеграции, пространственной ориентации и процессов двигательного выхода.
В настоящем исследовании мы изучаем один из самых ранних этапов обработки зрительного движения у лиц с постконтузионной гиперестезией движения. В частности, мы исследуем пороговые значения ключевого психофизического показателя, а именно пороговых значений временного разрешения зрительного восприятия, которые поддерживают обнаружение движения. Временное разрешение зрительного восприятия, часто называемое «скоростью зрения», в основном ограничивается максимальной частотой спайков нейронов сетчатки, что определяет верхнюю временную границу для интеграции стимулов в зрительном пути. Временная интеграция последовательных потенциалов действия от этих нейронов сетчатки составляет нейронную основу низкоуровневого восприятия движения. Зрительная система обнаруживает векторы движения и экстраполирует траектории объектов через короткие временные промежутки, суммируя временно смежные спайки. Следовательно, внутренние динамические характеристики спайков нейронов сетчатки устанавливают фундаментальный предел временной точности, с которой зрительные события могут быть закодированы и обработаны. Пороговые значения временного разрешения зрительного восприятия могут быть протестированы с помощью критической частоты мельканий (КЧМ) — верхнего предела частоты, выше которого реакция на периодически модулированный свет при любой амплитуде модуляции неотличима от реакции на постоянное поле той же средней яркости. Хотя временные пределы сетчатки определяются электрофизиологическими реакциями нейронов сетчатки, тестирование КЧМ у людей показало, что перцептивное обучение может повышать эти пороги, указывая на нейронную интеграцию и пластичность на пост-ретинальных стадиях. Пост-ретинальная модуляция критически наблюдается в скорости зрительной обработки, где известный электрофизиологический преимущество периферии над центральными областями становится более выраженным при измерении скорости зрительной обработки с помощью поведенческих задач. Хотя предыдущие результаты подтвердили, что временная интеграция зрительного движения может объяснить гиперестезию зрительного движения при постконтузионных пациентах, мало что известно о механизме, лежащем в основе этих аномалий. Является ли это вопросом пространственного положения стимулов, усиливающим центральную или периферическую реакцию сетчатки? Связан ли сдвиг с прерывистым контролем, с вариабельностью пороговых значений или с вниманием? Мы стремились выяснить, являются ли аномальные сдвиги в пороговых значениях временного зрительного восприятия специфичными для периферических областей поля зрения и связаны ли они с вариабельностью пороговых значений. Основываясь на данных об усиленной активности в зрительных кортикальных областях и повышенной вестибуло-окуломоторной реактивности во время оптокинетической стимуляции, мы предполагаем, что сдвиги в пороговых значениях временного зрительного восприятия могут присутствовать, и, возможно, повышены в периферических областях поля зрения. В этих областях, где мультисенсорная интеграция играет значительную роль в постуральном контроле и ощущении векции, такие изменения могут способствовать атипичной интеграции движения, приводящей к невестибулярному головокружению, наблюдаемому в этой популяции. Кроме того, мы исследуем связь между этими аномалиями и тяжестью симптомов.
Методы
Участники
Пятнадцать пациентов с персистирующими постконтузионными симптомами (ПКС) (10 женщин, средний возраст = 48,47 лет) были набраны из местных клиник нейрореабилитации и оптометрии, а также пятнадцать здоровых контрольных лиц соответствующего возраста (6 женщин, средний возраст = 38,53 лет), набранных через портал участия в исследованиях Каролинского института. Критерии включения для группы ПКС включали: (I) клинический диагноз сотрясения мозга ≥ 3 месяца назад, поставленный лицензированным неврологом, (II) отрицательные результаты нейровизуализации, (III) продолжающееся соответствие критериям ПКС по Международной классификации болезней, 10-го пересмотра (МКБ-10), с персистирующим дискомфортом и головокружением, вызванным движением, на момент тестирования. Среднее время с момента травмы составило 44,1 ± 44,4 месяца. Все пациенты ранее проходили клиническую оценку и соответствовали установленным рекомендациям по классификации ПКС. Все участники предоставили письменное информированное согласие, и исследование проводилось в соответствии с Хельсинкской декларацией. Включение участников, сбор данных, обработка персональных данных и настройка экспериментального протокола были одобрены Шведским управлением по этической экспертизе (одобрение этического комитета: 20230669602).
Перед включением каждый участник прошел комплексный набор клинических тестов. Критерии исключения включали: (I) нарушения окуломоторного контроля или функции глазодвигательных движений, определяемые клиническим осмотром окуломоторной функции, (II) любые задокументированные вестибулярные, соматосенсорные дефициты, (III) недавнее начало приема медикаментов, влияющих на центральную нервную систему (< 3 месяца), и (IV) любые диагностированные неврологические или сенсорные состояния, кроме ПКС. Офтальмологические обследования обеспечивали нормальную окуломоторную функцию и стереоскопическое зрение (тест TNO ≤ 60 угловых секунд). Периферическая вестибулярная целостность была подтверждена с помощью тестов импульсных отклонений головы во всех плоскостях полукружных каналов. Центральная вестибулярно-окулярная функция оценивалась путем проверки отсутствия отклонения глаз по вертикали. Соматосенсорный вклад в баланс оценивался с помощью принудительного теста Ромберга.
Оценка симптомов
Нейропсихолог проводил недирективные интервью для подтверждения статуса ПКС в соответствии с критериями МКБ-10, основываясь на клинической истории пациента и субъективной симптоматике. Все пациенты с ПКС проходили терапию зрительной реабилитации, начатую в течение предыдущего года, и ни один из них не сообщал о сопутствующих вмешательствах. Интервью также предоставляли сведения об образовании и профессиональном фоне для подбора контрольных групп. Опросник ситуативного головокружения (SVQ) использовался для количественной оценки тяжести симптомов (см. дополнительные материалы). Хроничность ПКС измерялась количеством дней с момента травмы (DFI), рассчитанным как время, прошедшее между датой сотрясения мозга, зафиксированной в национальной медицинской карте, и датой тестирования. Два пациента были исключены: один из-за ранее существовавшего аномального развития зрения и один из-за недоступности данных неврологического осмотра в национальных медицинских записях.
Прибор для стимуляции мельканием
Стимуляция мельканием генерировалась светодиодом (Bivar Orca R R20WHTF0160), управляемым многофункциональным устройством ввода-вывода (NI USB6001). Светодиод и управляющее устройство были размещены в корпусе, напечатанном на 3D-принтере. Регулируемая диафрагма регулировала выходной диаметр светового потока, а опаловый стеклянный фильтр обеспечивал равномерное распределение света.
Яркость светодиода модулировалась синусоидально вокруг базовой яркости (L0 = 50 кд/м2) с амплитудной модуляцией (m = 1) для 100% глубины модуляции, производя пики яркости 100 кд/м2 и минимумы 0 кд/м2. Частота мельканий (f) измерялась в Герцах (Гц), каждое стимулирование длилось 1 секунду. Аналоговый сигнал определялся как:
L(t) = L0 × (1 + m sin (2π ft)).
Окружное освещение сетчатки поддерживалось на уровне 30 лк (≈ 30 троландов, при допущении зрачка 2 мм), в то время как фоновая яркость составляла 2 кд/м2. Равномерность светового потока и точность формы волны мельканий проверялись фотометром (Hagner Universal Photometer S4), подключенным к осциллографу (Tektronix TBS1052C).
Оценка критической частоты мельканий (КЧМ)
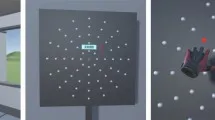
Круговые стимулы мелькания предъявлялись монокулярно на эксцентриситетах 5°, 10°, 20° и 40° от точки фиксации, как с носовой, так и с височной стороны поля зрения, что давало в общей сложности восемь позиций стимуляции, при этом голова участника находилась на упоре для подбородка на расстоянии 60 см от источника мелькания. Размер стимула масштабировался в соответствии с факторами кортикального увеличения, чтобы поддерживать постоянную площадь кортикальной проекции по всем эксцентриситетам, что приводило к угловым диаметрам (VAD) 0,46°, 0,74°, 1,31° и 2,55° при 5°, 10°, 20° и 40° соответственно.
Фиксирующий маркер с частотой 120 Гц (VAD 0,19°) оставался выше порога для обеспечения стабильной фиксации и использовался как эталон для определения режима мелькания целевого стимула. Перед каждым тестом проводился 1-минутный период адаптации при заданном эксцентриситете, в течение которого светодиод мерцал с частотой 120 Гц при средней яркости L0 как на целевом, так и на фиксирующем полях, обеспечивая равномерную адаптацию сетчатки. Участники тестировались с нормальным или скорректированным до нормального зрением, чтобы обеспечить одинаковую стимуляцию сетчатки во время тестирования.
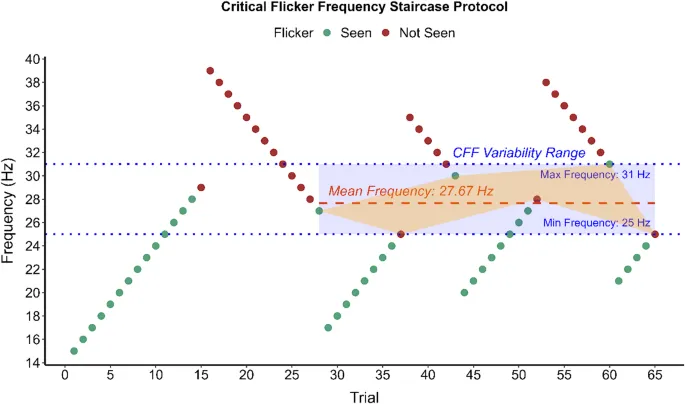
Пороговые значения КЧМ определялись с помощью процедуры ступенчатого изменения. Начиная с восходящей ступени с воспринимаемой частотой мельканий для каждого эксцентриситета, основанной на пилотных данных, частота увеличивалась на 1 Гц за каждую пробу до тех пор, пока участники не сообщали, что мелькание стало невоспринимаемым. Каждая восходящая ступень сопровождалась нисходящей ступенью, и наоборот, где начальная частота мельканий увеличивалась на дополнительные 10 Гц от предыдущего порогового значения восходящей ступени, прежде чем измениться и уменьшиться до тех пор, пока мелькание снова не стало воспринимаемым. Та же процедура с обратным понижением частоты на 10 Гц применялась для восходящей ступени после нисходящей ступени (см. Рис. 1). Внимание контролировалось с помощью контрольных проб (мелькание 120 Гц), вставляемых каждые 6–10 проб; невозможность обнаружить отсутствие мелькания в этих пробах аннулировала текущую ступень, требуя дополнительного измерения. Правильное фокусирование на целевом маркере контролировалось с помощью отслеживания взгляда с частотой 1000 Гц (SR Eyelink 1000 Plus). Генерация сигнала мельканий, синхронизация отслеживания взгляда, регистрация ответов и продвижение по ступеням контролировались скриптом MATLAB (MATLAB R2024b, The MathWorks, Inc.).
Измерения
Всего было проведено семь ступеней, при этом первая ступень исключалась из анализа. Пороговые значения КЧМ рассчитывались как среднее значение шести пороговых значений, по три из восходящей и по три из нисходящей ступени. Диаметр зрачка регистрировался одновременно, и его среднее значение рассчитывалось по всем пороговым пробам. Показатель вариабельности КЧМ, определяемый как разница между максимальным и минимальным пороговыми значениями в пределах шести ступеней, рассчитывался в соответствии с установленными рекомендациями (см. Рис. 1 и Табл. 1).
Статистический анализ
Все анализы проводились с использованием SPSS Statistics 28 (IBM Corp., Armonk, NY, USA). Для всех статистических тестов, выполненных в анализе, был установлен двусторонний уровень значимости альфа 0,05. Анализ мощности проводился для окончательной модели пороговых значений КЧМ с использованием скрипта R (пакеты lme и simr). Модель анализа мощности тестировалась с ковариатами на уровне субъекта для воспроизведения обобщенной линейной смешанной модели (GLMM). Параметры дизайна включали две группы (по 15 участников в каждой), четыре уровня повторных измерений (фактор эксцентриситета), Rho, равное 0,77, как наблюдалось в корреляции компаундной симметрии между измерениями, размер эффекта (бета наклона) = 0,20, с общим количеством симуляций, установленным на пятьсот. Модель достигает 100,0% мощности (95% ДИ: 99,26–100,0).
Предварительный анализ
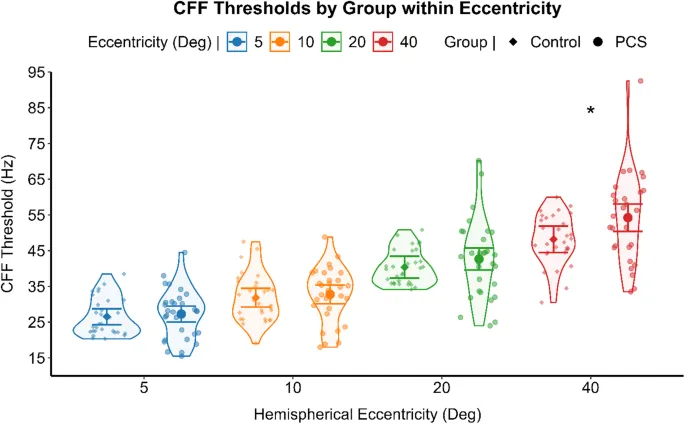
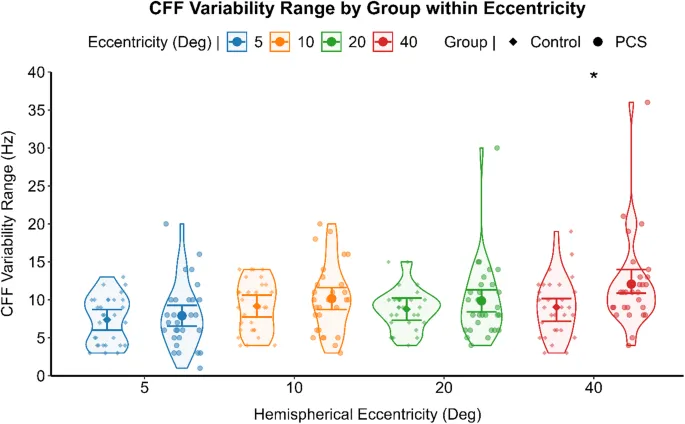
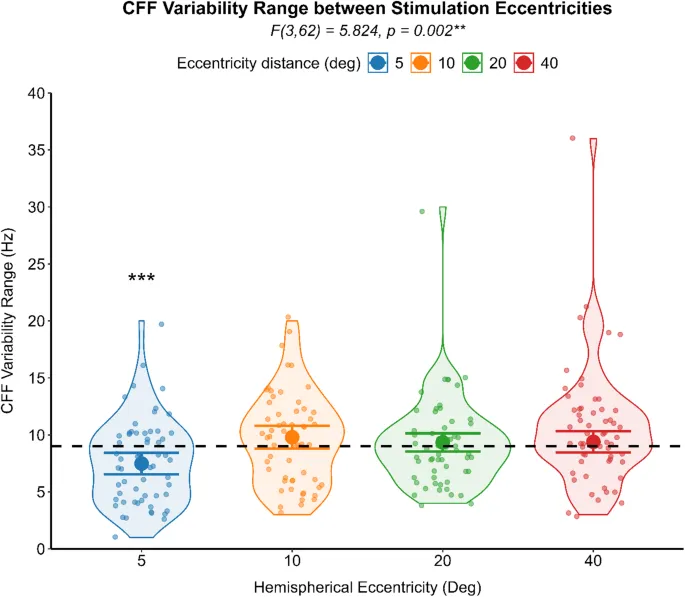
Корреляция между пороговыми значениями критической частоты мельканий (КЧМ) и показателем вариабельности КЧМ, оцененная с помощью непараметрической корреляции для каждой группы, показала значимую положительную корреляцию между двумя психометрическими показателями в здоровой группе (Спирмен ρ (120) = 0,214, p = 0,019) и в группе ПКС (Спирмен ρ (118) = 0,381, p < 0,001). Различия в пороговых значениях КЧМ и показателях вариабельности КЧМ анализировались с помощью раздельной GLM для каждого уровня эксцентриситета стимуляции. Лица с ПКС сообщили о значительно более высоких пороговых значениях КЧМ (F (1,56) = 5,270, p = 0,025) (см. Рис. 2) и более высоком показателе вариабельности КЧМ (F (1,56) = 5,225, p = 0,026) (см. Рис. 3) при наиболее периферическом эксцентриситете стимуляции по сравнению со здоровыми лицами. Обобщенная линейная смешанная модель (GLMM) с функцией связи идентичности использовалась для сравнения вариабельности КЧМ (зависимая переменная) между группами ПКС и здоровыми, используя группу как фактор между субъектами. Участники были включены как случайный эффект, а поле зрения и эксцентриситет моделировались как повторные измерения, с размером зрачка в качестве ковариаты. При контроле размера зрачка и межсубъектной вариабельности, когда участники являются случайным фактором, вариабельность КЧМ не отличалась значительно между группами (F (1,25) = 1,480, p = 0,235), причем здоровые люди (среднее = 8,39, 95% ДИ [2,08, 14,70]) и лица с ПКС (среднее = 9,57, 95% ДИ [3,25, 15,89]) сообщали о сопоставимых результатах. Вариабельность КЧМ, напротив, значительно зависела от эксцентриситета стимуляции (F (3,52) = 5,824, p = 0,002). Пост-хок анализ отклонения от среднего контраста с последовательной коррекцией Бонаферрони для множественных сравнений выявил значимо более низкую вариабельность КЧМ только при самой центральной стимуляции (разница средних = 1,517, SE = 0,36, 95% ДИ [2,45, 0,57], p < 0,001) (Рис. 4).
Модель КЧМ
В соответствии с анализом, представленным по показателю вариабельности КЧМ, для сравнения пороговых значений критической частоты мельканий (КЧМ) (зависимая переменная) и групп (пациенты с персистирующими постконтузионными симптомами (ПКС) и здоровые люди) в качестве фактора между субъектами использовалась обобщенная линейная смешанная модель (GLMM) с функцией связи идентичности. Участник был включен как случайный фактор, а поле зрения и эксцентриситет моделировались как повторные измерения. Группа, эксцентриситет и взаимодействие между группой и эксцентриситетом рассматривались как фиксированные эффекты в модели. Средний размер зрачка и диапазон вариабельности КЧМ рассматривались как ковариаты и включались в модель, взаимодействуя с фактором группы. Для оценки взаимосвязей между симптомами и показателями КЧМ в группе ПКС использовался корреляционный анализ Спирмена для оценки взаимосвязи между тяжестью симптомов (оценки SVQ) и временем с момента травмы с пороговыми значениями КЧМ и вариабельностью КЧМ.
Результаты
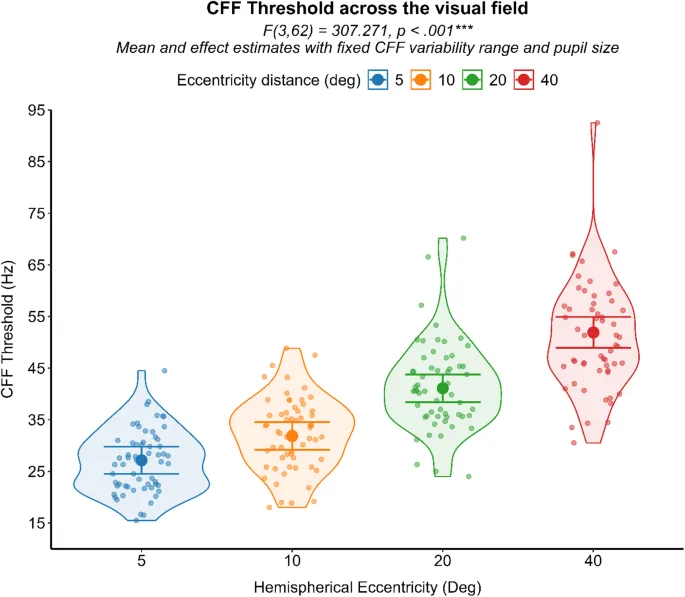
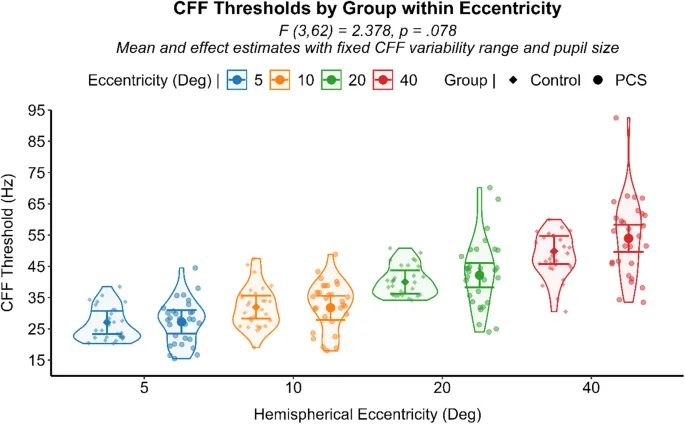
Согласно обобщенной линейной смешанной модели, эксцентриситет значительно влиял на пороговые значения КЧМ (F (3,62) = 307,271, p < 0,001), указывая на то, что периферические области поля зрения были связаны с более высокой обработкой временного разрешения по сравнению с более центральными областями. Этот результат, наблюдавшийся независимо от принадлежности к группе, соответствует установленной предыдущей литературе, поддерживая достоверность текущего индивидуально разработанного экспериментального аппарата и более быструю зрительную обработку в периферической, а не в центральной части поля зрения. (Рис. 5).
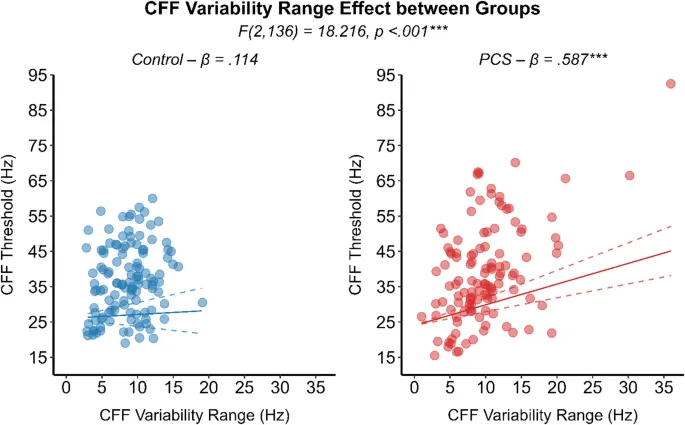
Кроме того, было отмечено значимое взаимодействие между вариабельностью КЧМ и группами (F (2,136) = 18,216, p < 0,001). В частности, вариабельность КЧМ значительно в большей степени повышала пороговые значения КЧМ в группе ПКС (β = 0,587, SE = 0,09, 95% ДИ [0,39, 0,78], p < 0,001) по сравнению с здоровыми людьми (β = 0,114, SE = 0,17, 95% ДИ [0,22, 0,45], p = 0,505) (Рис. 6). Хотя вариабельность КЧМ и пороговые значения КЧМ были положительно коррелированы в обеих группах, ее влияние на повышение порогового значения КЧМ было в пять раз выше в группе ПКС. Сопоставимая вариабельность КЧМ между группами, наряду со значительно уменьшенной величиной в областях поля зрения с более высоким соотношением сигнал/шум, предполагает, что перцептивный шум может лежать в основе наблюдаемой вариабельности КЧМ, которая, в свою очередь, значительно повышала пороговые значения КЧМ в группе ПКС. При оценке всех уровней эксцентриситета вместе и корректировке на вариабельность КЧМ и размер зрачка в качестве ковариат, лица с ПКС демонстрировали тенденцию к увеличению пороговых значений КЧМ в периферии по сравнению с контрольной группой (F (3,62) = 2,378, p = 0,078) (см. Рис. 7). Анализ ранговой корреляции Спирмена выявил значимую отрицательную взаимосвязь между днями с момента травмы (DFI) и вариабельностью КЧМ (ρ (118) = -0,212, p = 0,021), указывая на то, что у лиц с более длительными посттравматическими интервалами наблюдалась тенденция к более низкой вариабельности их пороговых значений КЧМ. С другой стороны, субъективный опросник симптомов не показал никакой связи с какими-либо измерениями обработки временного зрительного разрешения.
Обсуждение
Данное исследование стремилось прояснить роль нарушений низкоуровневой обработки зрительного движения у лиц с персистирующей постконтузионной чувствительностью к движению. Наши результаты подтвердили, что пороговые значения временного разрешения зрительного восприятия (КЧМ) увеличиваются с эксцентриситетом сетчатки, в соответствии с предыдущей литературой, тем самым поддерживая надежность нашего индивидуально разработанного светодиодного стимулятора мельканий. Этот эффект присутствовал независимо от статуса ПКС, усиливая представление о том, что фундаментальные свойства временной обработки сенсорной информации и восприятия остаются нетронутыми и следуют типичным пространственным моделям.
Наш анализ выявил, что перцептивный шум, в виде вариабельности пороговых значений КЧМ в пределах одного и того же блока стимуляции, сильно влияет на пороговые значения временного разрешения зрительного восприятия в популяции ПКС. Хотя перцептивный шум присутствует в одинаковой степени в обеих популяциях и в целом повышает пороговые значения временного разрешения в обеих популяциях, величина такого увеличения была в пять раз выше для популяции ПКС. Эти результаты предполагают, что пациенты, перенесшие легкую черепную травму, могут подвергаться тонким нарушениям на самых ранних этапах обработки зрительного движения. В частности, наблюдение, что повышенная временная зрительная чувствительность обусловлена перцептивным шумом, указывает на изменения в передаче сигналов и закономерностях нейронной активности. Функциональные и структурные изменения связности в зрительной системе уже были описаны, поддерживая идею измененной передачи сигналов. Кроме того, несколько исследований сообщили об изменениях в вызванных событиями потенциалах (ERPs) в зрительной коре, указывающих на более низкую силу передачи сигнала наряду с более высоким нейронным шумом. Потенциальная объяснительная основа для сдвигов временной зрительной чувствительности из-за перцептивного шума, наблюдаемого в текущем исследовании, может заключаться в концепции стохастического резонанса и роли внутреннего нейронного шума. Предыдущие вычислительные модели и нейрофизиологические исследования предполагают, что низкоуровневый нейронный шум может изменять пороговые значения нейронной активности, эффективно сдвигая диапазоны чувствительности. В здоровой нервной системе умеренные уровни внутреннего шума могут улучшить обнаружение сигнала при определенных условиях, но в мозге с сотрясением мозга, нерегулируемые уровни шума могут дестабилизировать нормальные настройки пороговых значений, сглаживая сигмоидальную функцию, которая обычно формирует вероятность нейронной активности и обнаружение сигнала. Это возмущение может нарушить настройку ранних перцептивных фильтров, увеличивая реактивность пациентов к зрительному движению и, следовательно, делая их более восприимчивыми к дискомфорту, вызванному движением. По мере сдвига весов чувствительности входные данные для процессов мультисенсорной интеграции становятся менее когерентными, что еще больше усугубляет перцептивную нестабильность.
Наличие повышенной временной зрительной чувствительности, обусловленной перцептивным шумом, предполагает, что локальная зрительная сеть может функционировать в состоянии повышенной нерегулярности. В такой более хаотичной обстановке облегченная диффузия может усилить распространение сигнала по сети и связанным путям. Аналогичные явления наблюдались в предыдущих исследованиях, демонстрирующих, что повышенная чувствительность к зрительному движению может влиять на вестибулярную и окуломоторную функцию. Хотя явные структурные повреждения вестибулярного аппарата и центров окуломоторного управления могут отсутствовать, их эффективное функционирование зависит от когерентного зрительного ввода. Способность обнаруживать движение, как мы проверяли через пределы обработки временного разрешения, не подразумевает способности субъекта к точной экстраполяции движения. Несмотря на предыдущую литературу, поддерживающую положительную взаимосвязь между скоростью зрительной обработки и обнаружением движения, повышенная обработка временного разрешения, наблюдаемая при ПКС, в основном обусловлена интервальным шумом. Тенденция к увеличению обработки временного разрешения в периферических областях, где соотношение сигнал/шум в целом уменьшается, усугубляет эффект шума в модуляции сенсорного порога, хотя такой эффект уже присутствует независимо от эксцентриситета стимуляции в популяции ПКС. В то время как обработка временного разрешения, кажется, имеет теоретическое преимущество для популяции ПКС, обнаружение движения и экстраполяция движения в экологических условиях требуют, чтобы зрительная система точно кодировала сигнал движения и векторы, одновременно подавляя влияние фонового шума. Такая концепция особенно очевидна в других аналогичных клинических популяциях с визуальной гиперестезией движения, где способность экстраполировать когерентное направление движения из фонового шума нарушена по сравнению со здоровыми людьми. В результате факторы, модулирующие пороги чувствительности и способность к экстраполяции движения в популяции ПКС, указывают на чрезмерно шумную систему зрительного движения.
Наблюдаемая отрицательная корреляция между хроничностью (дни с момента травмы) и вариабельностью КЧМ, хотя и слабая, подразумевает, что со временем частичная неврологическая рекалибровка или компенсаторные процессы могут уменьшить эту нерегулярность. Более длительные посттравматические интервалы могут позволить остаточным нейронным цепям адаптироваться, частично восстанавливая более стабильные пороговые значения временного разрешения за счет снижения внутреннего шума. Тем не менее, сохранение аномальной чувствительности к движению у многочисленных пациентов указывает на то, что эти компенсаторные адаптации остаются неполными и требуют дальнейшего изучения.
Необходимо признать несколько ограничений. Размер выборки, хотя и показал достаточную мощность для исследования, был относительно мал, а наши измерения были сосредоточены в основном на поведенческих и перцептивных результатах, а не на прямых нейрофизиологических записях. Следовательно, мы не можем окончательно определить точные нейронные механизмы или области мозга, ответственные за наблюдаемую вариабельность. Будущие исследования с использованием передовых методов визуализации или нейрофизиологической оценки могли бы дать более подробную картину этих процессов. Кроме того, участники проходили различные этапы реабилитации, что потенциально влияло на их перцептивные показатели и пластичность их сенсорных систем. Это предположение далее поддерживается наблюдаемым снижением нестабильности пороговых значений с увеличением времени с момента травмы. Для учета межсубъектной вариабельности каждый участник был включен как случайный фактор в модель, что позволило оценить эффекты на индивидуальном уровне. В то время как такие факторы, как усталость и бдительность, распространены при ПКС, эти воздействия контролировались с помощью контрольных проб и одновременных измерений зрачков. Сопоставимые размеры зрачков между группами предполагают одинаковые уровни усталости и бдительности, и результаты КЧМ были соответственно скорректированы на размер зрачка путем установки метрик зрачка в качестве ковариат в статистической модели, гарантируя, что наблюдаемые различия во временном разрешении не были вызваны этими сглаживающими факторами.
В заключение, наши результаты подтверждают мнение о том, что постконтузионная гиперестезия движения может быть вызвана тонкими нарушениями в низкоуровневой временной обработке зрительной информации. Данные указывают на взаимодействие между внутренним нейронным шумом и пороговыми значениями временного разрешения, влияющее на то, как сигналы зрительного движения обнаруживаются и интегрируются. Поскольку эти нарушения могут сохраняться со временем, даже если они частично ослабевают с увеличением посттравматических интервалов, изучение целенаправленных вмешательств, направленных на снижение перцептивного шума, может улучшить уход за пациентами. В частности, в дополнение к оптометрической реабилитации, которая занимается бинокулярными, окуломоторными и аккомодационными функциями, часто нарушенными после сотрясения мозга, включение задач обучения направлению движения, таких как предложенные Seitz et al., может улучшить зрительное внимание и сенсорное обучение. В этих протоколах было показано, что задачи внимания, выполняемые в присутствии фонового движения, улучшают пороги когерентности движения, напрямую отражая способность обнаруживать осмысленные сигналы движения среди шума. В конечном итоге, эти протоколы повысили критическую частоту мельканий (КЧМ); хотя вариабельность не оценивалась, результаты поддерживают связь между восприятием мельканий и обнаружением движения. Такие подходы могут в конечном итоге улучшить реабилитационные стратегии и улучшить клинические результаты для лиц, испытывающих персистирующую чувствительность к движению после легкой черепной травмы.