Интересное сегодня
Психологическое состояние до и после бариатрической операции...
Психопатологический профиль до и после бариатрической операции Предоперационная психопатологическая...
Как взаимодействуют пространственное и временное внимание в ...
Введение Пространственное внимание может распределяться скрыто, без движения глаз. Эндогенное (произ...
Как мозг определяет проигравших: новая разгадка социальных и...
Нейронная основа проигрыша: как мозг реагирует на поражение Исследователи совершили прорыв в понима...
Как трудности с концентрацией и негативные мысли влияют друг...
Ежедневные трудности с концентрацией могут усиливать и подпитываться негативными мыслями Для многих ...
Как визуальная обратная связь и мотивация влияют на точность...
Введение Повседневная деятельность требует точного контроля генерации силы. В качестве примера можно...
Как взгляд и мимика робота влияют на чувство контроля челове...
Введение: что такое чувство контроля (Sense of Agency) Чувство контроля (Sense of Agency, SoA) — это...
Исследование вариабельности ЭЭГ для диагностики расстройств аутистического спектра с помощью машинного обучения
Введение
Расстройство аутистического спектра (РАС) – это сложное нейроразвитийное состояние, характеризующееся особенностями в социальной коммуникации, поведении и сенсорной обработке (APA, 2013). Термин «спектр» отражает огромную гетерогенность симптомов, когнитивных способностей и функциональных исходов среди людей с РАС (Halder et al., 2024; Smith et al., 2024). Несмотря на растущее признание этой гетерогенности, отсутствие биомаркеров, основанных на механистическом понимании, является критическим барьером для разработки более целенаправленных методов лечения, включая диагностическую стратификацию, фенотипирование и выявление групп, релевантных для лечения (Biomarkers Definitions Working Group., 2001).
Электроэнцефалография (ЭЭГ) – неинвазивный инструмент с высоким временным разрешением – предлагает многообещающий путь для открытия биомаркеров РАС (Bosl et al., 2011; Frye et al., 2019; Garcés et al., 2022; Webb et al., 2023). Недавние многоцентровые исследования, такие как Autism Biomarkers Consortium for Clinical Trials (Консорциум биомаркеров аутизма для клинических испытаний), продемонстрировали клиническую полезность показателей на основе ЭЭГ как для диагностики, так и для мониторинга лечения (Webb et al., 2023). Эти достижения согласуются с результатами исследований развития нейровизуализации, показывающих измененную динамику сетей и атипичное созревание мозга при РАС (Rea et al., 2023), подчеркивая потребность в инструментах, способных улавливать сложность нейронной функции.
Хотя ЭЭГ показывает перспективность в качестве метода открытия биомаркеров РАС, извлечение значимых паттернов из больших наборов данных является сложной задачей из-за сложности нейронной активности, и традиционные подходы часто не способны уловить эту сложность. Машинное обучение (ML, Machine Learning) все чаще становится стандартным аналитическим инструментом в исследованиях ЭЭГ, а модели контролируемого машинного обучения, такие как машины опорных векторов (SVM, Support Vector Machines) и нейронные сети, более точно классифицируют РАС, используя такие характеристики ЭЭГ, как спектры мощности и когерентность (Bosl et al., 2017; Das et al., 2023; Grossi et al., 2021; Pagnozzi et al., 2018; Rajula et al., 2020). Более того, интерпретируемые методы машинного обучения дают критически важное понимание наиболее диагностически релевантных характеристик ЭЭГ, закладывая основу для персонализированной оценки РАС на основе биомаркеров (Ranaut et al., 2024).
Однако традиционные подходы к ЭЭГ часто опираются на усредненные по пробам метрики, потенциально скрывая значимую вариабельность внутри субъекта. Основываясь на фундаментальных выводах в этой области, исследования, использующие метрики энтропии и сложности (Bosl et al., 2011, 2017), и многочисленные исследования межприбыльной когерентности (ITC, Intertrial Coherence) последовательно показывали, что вариабельность нейронного сигнала, а не статичные характеристики ЭЭГ, может лучше отражать нейробиологические различия при РАС. «Тезис о нейронной ненадежности» (neural unreliability thesis, Butler et al., 2017) далее синтезирует эту работу, предполагая, что повышенные флуктуации ЭЭГ от пробы к пробе отражают основную характеристику атипичного нейронного функционирования при аутизме. Эти флуктуации, связанные с сенсорной чувствительностью, когнитивной согласованностью и индивидуальными поведенческими чертами (Arutiunian et al., 2024; Dinstein et al., 2015; Neuhaus et al., 2021), могут отражать значимые различия в гибкости нейронных цепей и стабильности обработки (David et al., 2016; Milne, 2011; Markram et al., 2007), а не просто шум. Важно отметить, что сама по себе вариабельность не является неадаптивной; здоровое функционирование мозга зависит от оптимального баланса стабильности и гибкости ((Pinneo, 1966)).
Хотя предыдущие работы заложили критически важную основу, наш текущий подход систематически количественно оценивает спектральную вариабельность между пробами и напрямую сравнивает ее полезность с чисто средними показателями ЭЭГ в крупномасштабных, свободных от смещений кросс-валидированных экспериментах с инструментами машинного обучения, обеспечивая строгую проверку и ключевое расширение гипотез, выдвинутых Butler et al. (2017) и смежными исследованиями. Наша цель — не предложить диагностический биомаркер, а продемонстрировать, что нейронная вариабельность является недостаточно используемым измерением данных ЭЭГ, которое может улучшить классификацию на основе машинного обучения и должно учитываться при разработке будущих биомаркеров.
Ключевое ограничение в исследованиях биомаркеров РАС на основе ЭЭГ – это опора на усредненные по пробам данные, которые могут упускать из виду важную внутрисубъектную вариабельность. Появляющиеся данные свидетельствуют о том, что характеристики самой нейронной вариабельности, а не абсолютные различия в сигнале, могут быть решающим диагностическим маркером для РАС (Dinstein et al., 2015; Milne, 2011). Люди с аутизмом часто демонстрируют большие флуктуации от пробы к пробе как в состоянии покоя, так и при выполнении задач в ЭЭГ-активности, отражая различия в стабильности сенсорной обработки, когнитивной согласованности и гибкости нейронных цепей (David et al., 2016; Dakin & Frith, 2005; Haigh et al., 2015; Markram et al., 2007; Simmons et al., 2009). Вместо того чтобы отражать простой шум, эти флуктуации могут отражать значимые различия в нейронной обработке, которые влияют на восприятие, поведение и обучение, но которые не улавливаются традиционными методами анализа ЭЭГ. Вместо того чтобы представлять шум, вариабельность предлагает многообещающее измерение для понимания нейробиологической гетерогенности при аутизме, дополняя другие установленные подходы. Изучение нейронной вариабельности является ключом к пониманию сенсорной чувствительности, социальной и когнитивной согласованности, а также персонализированных вмешательств при РАС. В то же время, здоровое функционирование мозга нуждается в правильном количестве вариабельности (Pinneo, 1966; Waschke et al., 2021), подчеркивая необходимость точного количественного определения нейронной вариабельности.
Данное исследование систематически оценивает характеристики вариабельности ЭЭГ как кандидатов в рамках разработки биомаркеров, сравнивая спектральную вариабельность между пробами с обычным комплексным набором признаков («AllTrial») и усредненными по пробам метриками («AvgTrial») в различении аутизма и типичного развития. В этом исследовании мы предполагали повышение точности классификации для спектральных признаков ЭЭГ между пробами («AcrossTrial») в различении аутизма и типичного развития по сравнению с традиционными признаками MeanEEG и Alltrial. Сосредоточившись на признаках спектра мощности, мы применили четыре модели машинного обучения: логистическую регрессию, машины опорных векторов, случайные леса и нейронные сети. Признаки AcrossTrial последовательно демонстрировали преимущества перед MeanEEG в различных моделях. Анализ важности признаков выделил вариабельность спектра мощности как информативный признак для классификации, подчеркивая ценность включения метрик нейронной вариабельности в будущие исследования биомаркеров. Эти выводы оставались высоко последовательными в кросс-валидационных фолдах и значительно коррелировали с поведенческими показателями, подчеркивая их клиническую релевантность и обобщаемость.
Методы
Сбор данных и демография
Наш набор данных включает данные ЭЭГ в состоянии покоя от 94 участников с РАС и 96 типично развивающихся участников (TDC, Typically Developing Comparison) из проекта Autism Center for Excellence (ACE) «Мультимодальная нейрогенетика развития женщин с РАС» (исследование NDAR #2021), обобщенные в Таблице 1. Данные были собраны в Детской больнице Бостона (BCH, Boston Children’s Hospital), Исследовательском институте детской больницы Сиэтла (SCRI, Seattle Children’s Research Institute), Калифорнийском университете в Лос-Анджелесе (UCLA, University of California Los Angeles) и Йельском университете. Координацией сбора данных занимался Университет Южной Калифорнии (USC, University of Southern California). Набор проводился с помощью листовок и списков потенциальных участников, процедуры контролировались местными комитетами по этике и IRB Йельского университета. Из 339 участников 289 предоставили ЭЭГ-данные без артефактов. Подробная информация о наборе, стратификации, поведенческой поддержке во время сбора данных, протоколах ЭЭГ и ролях персонала доступна в (Neuhaus et al., 2021). Наше ретроспективное исследование анализировало данные из подмножества из 190 участников, обобщенных в Таблице 1, которые соответствовали дополнительным установленным нами критериям: наличие ≥128 секунд ЭЭГ в состоянии покоя, отсутствие родственных связей и наличие диагностических оценок и поведенческих фенотипов, доступных нам после передачи деидентифицированных данных. Наш ретроспективный анализ собранных данных соответствует стандартным протоколам OHBM (Pernet et al., 2020) и GREENBEAN (фаза 2) (Ewen et al., 2025).
Таблица 1. Демографические данные с диапазонами баллов по шкале социальной отзывчивости (SRS, Social Responsiveness Scale), сенсорного профиля и IQ участников исследования. Сводная статистика каждой подгруппы представлена в следующем формате: Среднее ± стандартное отклонение (минимум, максимум). ASD: Расстройство аутистического спектра, TDC: Типично развивающаяся контрольная группа. *Это исключает 8 участников с РАС и 7 участников TDC без баллов SRS
Сбор данных
Сбор данных проводился с использованием системы EGI 128-канальных Net Amps 300 с сетками HydroCel (EGI Inc., Eugene, OR) и программного обеспечения Net Station версий 4.4.2, 4.5.1 или 4.5.2 в соответствии со стандартизированным протоколом. Стимулы предъявлялись с помощью программного обеспечения EPrime 2.0. Процедура включала три сессии, каждая из которых состояла из шести 16-секундных блоков, чередующихся с видеофрагментами (с медленно движущимися динамическими изображениями) и интервалами с закрытыми глазами. Сеансы ЭЭГ длились около 60 минут, с фиксированной последовательностью задач, из которых мы сегментировали данные ЭЭГ в состоянии покоя, записанные во время фазы с открытыми глазами.
Предварительная обработка ЭЭГ
Непрерывные 128-канальные данные ЭЭГ от каждого участника фильтровались полосовым фильтром в диапазоне 1–100 Гц, а также с помощью режекторного фильтра на частоте 60 Гц. Частота дискретизации составляла 500 Гц. Мы использовали конвейер HAPPE v4 для автоматической обработки отфильтрованных данных (Gabard-Durnam et al., 2018). Этот конвейер включал вейвлет-пороговую независимую компонентную анализ (WICA, Wavelet thresholded Independent Component Analysis) для удаления множества классов артефактов, включая, но не ограничиваясь, морганием глаз и разрывами сигнала. За процедурой WICA следовали обнаружение плохих каналов и второй этап ICA, называемый MuscIL, для удаления мышечных артефактов с использованием алгоритма ICLabel (Pion-Tonachini et al., 2019). Затем непрерывные данные ЭЭГ сегментировались и разделялись на интервалы REST длительностью 2.042 секунды, начиная за 0.01 секунды до метки события и продолжаясь до 2.038 секунды, что давало 1024 выборки на сегмент. Отклонение плохих сегментов проводилось с порогом 100 микровольт по всем каналам. Наконец, данные интерполировались для завершения отсутствующих и/или отклоненных сегментов и ре-реферировались к среднему референсу.
Многоуровневое извлечение признаков
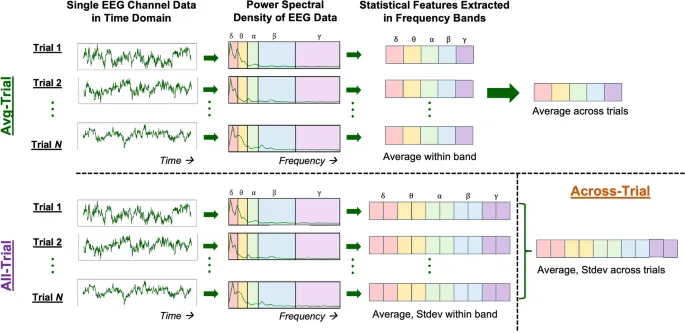
Наш окончательный набор данных для каждого участника включал 64 пробы по 1024 выборки каждая (длительностью 2.048 секунды). Каждая проба содержала данные для 128 каналов ЭЭГ. Как показано на Рис. 1, мы извлекли три типа признаков из этих данных, описанных ниже:
- Набор признаков AvgTrial (усредненный по пробам): В этой категории мы следовали стандартной процедуре вычисления мощности в ЭЭГ покоя. Мы вычисляли плотность спектра мощности (PSD, Power Spectral Density) для каждого из 128 каналов ЭЭГ в каждой из 64 проб отдельно. PSD вычислялась методом Уэлча (Welch, 1967) на каждой 1024-выборочной пробе ЭЭГ с использованием окон Хэмминга длиной 512 выборок с 50% перекрытием между окнами. Затем мы усредняли частоты, включенные в каждый из пяти диапазонов: дельта (1–4 Гц), тета (4–8 Гц), альфа (8–12 Гц), бета (13–30 Гц) и гамма (30–40 Гц). Наконец, мы усреднили по 64 пробам, получив набор признаков, содержащий 640 признаков (128 каналов × 5 диапазонов × 1 статистика = 640 признаков всего).
- Набор признаков AllTrial (все пробы): Здесь мы сохранили признаки PSD из отдельных проб для сравнения. В частности, после вычисления PSD на сегмент методом Уэлча, мы вычислили среднее и стандартное отклонение в пяти частотных диапазонах для всех 64 проб. Эта процедура привела к созданию набора признаков, содержащего 81 920 признаков (128 каналов × 5 диапазонов × 2 статистики × 64 пробы = 81 920 признаков всего).
- Набор признаков AcrossTrial (между пробами): Это наш предлагаемый тип признаков, где мы стратегически снижаем размерность набора признаков AllTrial. Мы вычисляем среднее и стандартное отклонение признаков по 64 пробам, что приводит к созданию набора признаков, содержащего 5 120 признаков (128 каналов × 5 диапазонов × 4 статистики × 2 (среднее/ст. отклонение между пробами) = 5 120 признаков всего).
Все наборы признаков были нормализованы методом Z-оценки (Z-score) для поддержания согласованного диапазона значений признаков перед дальнейшим анализом (Abdi & Williams, 2010) с инструментами машинного обучения.
Рис. 1. Конвейер извлечения признаков для наборов признаков AvgTrial, AllTrial и AcrossTrial для данных одного канала ЭЭГ. Этот процесс повторяется для всех 128 каналов данных ЭЭГ. Частотные диапазоны обозначены как дельта δ, тета θ, альфа α, бета β, гамма γ.
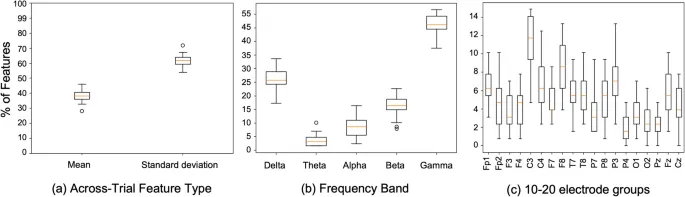
Рис. 2. Ящичковые диаграммы процентного распределения важных признаков по (a) типам признаков: среднее и стандартное отклонение, (b) пяти частотным диапазонам, (c) различным областям электродов, сгруппированным по монтажу 10–20 для лучшей интерпретации. Признак считается важным, если он имеет наивысшее значение параметра в лучшей модели логистической регрессии AcrossTrial. Каждая коробка представляет среднее и разброс по 25 моделям кросс-валидации.
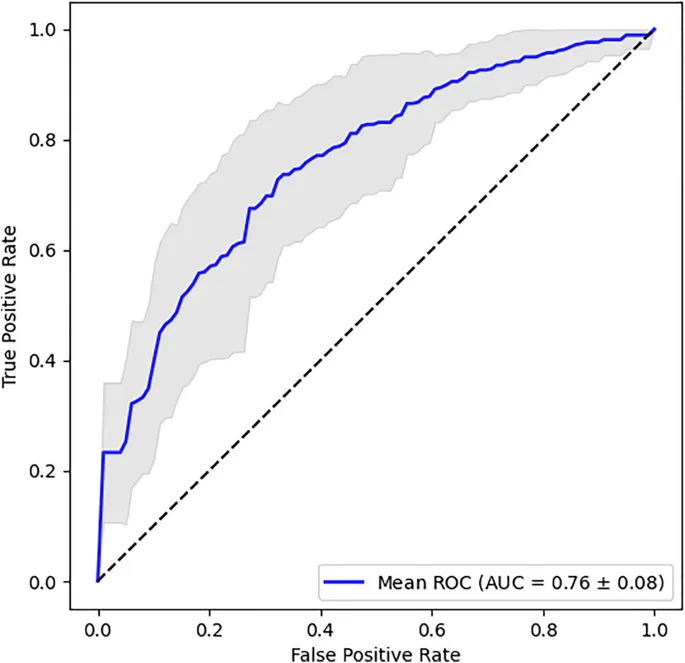
Рис. 3. Рабочая характеристика приемника (ROC, Receiver Operator Curve) для лучшей модели LR на признаках ЭЭГ AcrossTrial. Средняя кривая ROC из 25 кросс-валидированных моделей построена синим цветом, стандартное отклонение изображено серым. Средняя площадь под ROC (AUROC, Area Under ROC) составляет 0.76 ± 0.08.
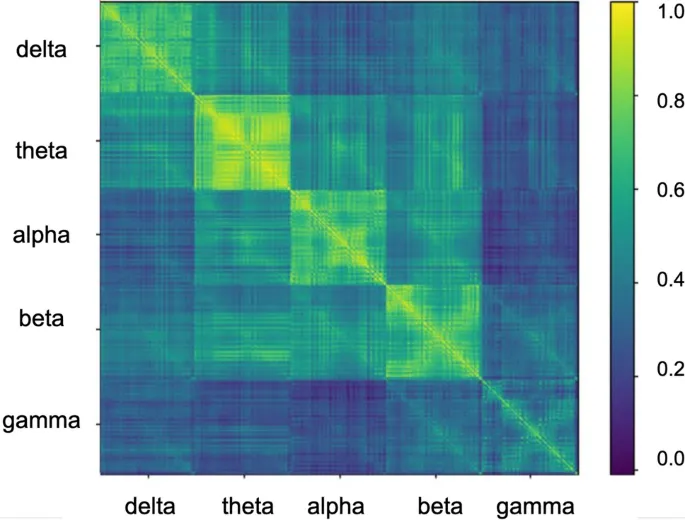
Рис. 4. Матрицы корреляции Пирсона агрегированных признаков между участниками. Извлеченные признаки всех участников сначала группируются по 128 электродам и 5 частотным диапазонам путем усреднения на уровне участника. Затем вычисляется корреляция Пирсона, что приводит к получению большой матрицы размером 640×640 (128 каналов электродов в 5 частотных диапазонах). Цветовая шкала справа указывает диапазон значений и соответствующий ему цвет. Ярко-желтый означает значение, близкое к 1, т. е. высокую корреляцию. Синий означает нулевую корреляцию, а индиго – низкую отрицательную корреляцию.
Экспериментальный дизайн и статистический анализ
Четыре модели машинного обучения (логистическая регрессия (LR, Logistic Regression), случайный лес (RF, Random Forest), машина опорных векторов с ядерной функцией (SVM, Support Vector Machine) и искусственная нейронная сеть (ANN, Artificial Neural Network)) были обучены на наборах признаков MeanEEG, Alltrial и AcrossTrial соответственно. Модели были выбраны исходя из их интерпретируемости (LR), скорости обучения (LR), способности обрабатывать высокую размерность (RF, SVM) и способности улавливать сложные взаимосвязи с использованием глубокого обучения (ANN). Стратифицированная пятикратная кросс-валидация, которая обеспечивала 5 фолдов с 80% обучающих и 20% тестовых наборов, имеющих такую же пропорцию РАС и TDC, как и исходный набор данных, повторялась 5 раз с использованием 5 различных случайных перемешиваний, согласованных для всех четырех моделей. Эта процедура позволила создать 25 кросс-валидированных моделей для каждого из 12 методов (4 ML × 3 набора признаков).
Принимая РАС как «положительный» класс, модели оценивались по четырем метрикам: точность (accuracy), F1-оценка (гармоническое среднее точности и полноты), площадь под рабочей характеристикой приемника (AUROC) и площадь под кривой точность-полнота (AUPRC, Area Under the Precision-Recall Curve). AUROC измеряет способность модели различать классы со сбалансированным соотношением истинноположительных и ложноположительных показателей, а AUPRC оценивает способность модели точно идентифицировать класс РАС с минимальным количеством ложных предсказаний. Кроме того, в пост-хок анализах мы оценили корреляцию между высокоинформативными значениями признаков PSD AcrossTrial и оценками SRST (Constantino, 2021) и сенсорного профиля (Dunn, 2014) участников с РАС с использованием тестов частичной корреляции.
С точки зрения реализации LR, мы использовали бинарную кросс-энтропийную функцию потерь, решатель BFGS с ограниченной памятью и L2-регуляризацию с силой λ = 1.0. Для RF мы использовали 100 деревьев решений, критерий Джини для разделения деревьев и отсутствие бутстрэп-выборки из-за использования стратифицированной кросс-валидации. Для SVM мы использовали линейное ядро, функцию потерь hinge и L2-регуляризацию с длиной λ = 1.0. Наша ANN имела несколько плотных слоев, начиная со слоя из 1024 нейронов, за которым следовали слои из 512, 256 и 64 нейронов, все с функциями активации ReLU. Также были добавлены слои пакетной нормализации и отсева (dropout) с коэффициентом 0.5, а выходной слой имел один нейрон с сигмоидальной активацией для бинарной классификации. ANN обучалась с использованием оптимизатора Adam, бинарной кросс-энтропийной функции потерь и размера пакета 32 в течение 30 эпох. Все методы были реализованы с использованием легкодоступных пакетов Python в среде CPU с помощью пакетов scikit-learn, scipy, numpy и statsmodels.
Результаты
Метрики производительности
Мы сравнили четыре метрики оценки по двенадцати экспериментам для оценки производительности прогнозирования РАС против TDC (Таблица 2). Модель LR, использующая набор признаков AcrossTrial, достигла самой высокой точности (0.707±0.080), AUPRC (0.775±0.064) и F1-оценки (0.702±0.077), а также сопоставимой оценки AUROC (0.760±0.075) среди всех методов, что указывает на хороший баланс между полнотой, специфичностью и точностью при классификации РАС. Улучшение точности в модели LR AcrossTrial статистически значимо по сравнению с наборами признаков AllTrial и AvgTrial, согласно парному t-тесту для гипотезы о том, что точность AcrossTrial выше, чем у других наборов признаков.
Таблица 2. Метрики оценки для каждой модели, обученной на каждом типе признаков. P-значения парного t-теста методом Уэлча между AcrossTrial с наборами признаков AllTrial и AvgTrial с гипотезой о том, что производительность AcrossTrial выше, сообщаются для каждой метрики во всех четырех алгоритмах ML. Наивысшие значения для каждого типа модели выделены жирным шрифтом.
Для более детального рассмотрения мы построили график средней кривой ROC, усредненной по результатам наших 25 моделей кросс-валидации, показывающий разумно хорошую производительность на Рис. 3. Принятие порога обнаружения 0.5 в нашей хорошо сбалансированной бинарной задаче (т. е. схожее количество участников с РАС и TDC в наборе данных) это соответствует чувствительности 0.703±0.102 и специфичности 0.710±0.127. Однако распространенность РАС в общей популяции составляет около 1.1–3.2% (Shaw, 2025). Принимая 3.2% как соотношение распространенности, это приводит к положительному прогностическому значению (PPV, Positive Predictive Value) 0.085±0.034 и отрицательному прогностическому значению (NPV, Negative Predictive Value) 0.986±0.006. Полученные значения PPV и NPV обусловлены редкостью аутизма, но, учитывая его растущую распространенность, эти значения указывают на то, что наш инструмент может потенциально служить хорошим скрининговым устройством для аутизма. Он также предоставляет ценную дополнительную информацию для научных исследований и существующих диагностических конвейеров. Добавление стандартного отклонения в качестве прокси для межприбыльной вариабельности улучшает производительность и может быть включено в существующие конвейеры, предоставляя более богатую информацию для диагностической стратификации и планирования лечения.
В целом, четыре модели машинного обучения продемонстрировали сопоставимую производительность с минимальными различиями, наблюдаемыми по метрикам оценки. Это предполагает, что любой хорошо обученный алгоритм машинного обучения достаточен для различения групп РАС и TDC. Хотя набор признаков AllTrial продемонстрировал точность выше случайной, его производительность была ниже, чем у других методов, что подчеркивает важность снижения размерности. Среди оцененных подходов набор признаков AcrossTrial оказался наиболее эффективным, обеспечив статистически значимые улучшения во многих моделях машинного обучения. Эти результаты подчеркивают силу стратегии извлечения признаков AcrossTrial, которая успешно улавливает существенную дискриминационную информацию для классификации, несмотря на использование входного размера в 32 раза меньшего, чем у набора признаков AllTrial.
Важность признаков
Для интерпретируемости мы провели пост-хок анализ важности признаков, чтобы выявить ключевые диагностические биомаркеры, сосредоточившись на модели логистической регрессии (LR) на основе набора признаков AcrossTrial. В частности, эта комбинация имеет преимущество отличной интерпретируемости и достигла наилучшего показателя точности в задаче классификации РАС. LR использует линейную модель, за которой следует сигмоидальная функция для взвешивания признаков для окончательного решения. Следовательно, параметры обученной линейной модели могут быть использованы для указания вклада конкретного признака в окончательное предсказание, как описано в Saarela и Jauhiainen (2021). Например, нулевое значение параметра указывает на то, что признак не влияет на задачу классификации, тогда как параметр с высоким абсолютным значением указывает на важность признака. Соответственно, мы сравнили абсолютную величину параметров модели LR AcrossTrial для количественной оценки важности признаков. Мы выбрали топ-5% признаков с наибольшей абсолютной величиной в каждой из 25 моделей кросс-валидации в качестве наших важных признаков.
Рис. 2 показывает ящичковую диаграмму распределения важных признаков в различных частотных диапазонах, типах признаков и областях электродов в 25 моделях LR, обученных посредством нашей системы стратифицированной кросс-валидации. Примечательно, что 62% важных признаков AcrossTrial относятся к «стандартному отклонению» между пробами, что значительно выше, чем «среднее» признаков между пробами. Этот результат подчеркивает значение межприбыльной вариабельности как важного индикатора диагностики РАС. В среднем по всем 25 моделям гамма- и дельта-диапазоны имеют наибольшее представительство в наборах важных признаков, со средним 47% и 26% топ-признаков, относящихся соответственно к гамма- и дельта-диапазонам. При агрегировании по областям распределение в основном однородно, с C3 в левом центральном, F8 в правом фронтальном и P3 в левом теменном участках, имеющих немного более высокое представительство в наборе важных признаков. Эти выводы предполагают наличие изменений в лежащих в основе характеристиках признаков между пробами в этих частотных диапазонах из разных участков мозга, что может помочь в диагностике. Однако для расширения этих наблюдений требуется дальнейшая валидация.
Корреляция с поведенческими фенотипами
Выбирая важные признаки, определенные нашей лучшей моделью LR AcrossTrial из 25 фолдов кросс-валидации, мы сгруппировали их по диапазонам и областям головы в соответствии с монтажом электродов 10–20, усреднив в этих обозначениях. Группировка была направлена на повышение интерпретируемости и значимости признаков по сравнению с большим количеством входных индивидуальных признаков ЭЭГ. Мы вычислили частичную корреляцию между признаками PSD региона и двумя типами поведенческих фенотипов, оценкой SRS T (Constantino, 2021) и оценкой сенсорного профиля (Dunn, 2014) по отдельности. Мы рассматривали пол и возраст как ковариаты, которые должны быть исключены из частичной корреляции в обоих случаях, так что сообщаемые оценки корреляции в Таблице 3 указывают только на связь между признаками ЭЭГ и оценкой SRS (верхняя часть) и оценкой сенсорного профиля (нижняя часть) отдельно. Сообщаемые p-значения скорректированы для множественных сравнений методом Бенджамини-Хохберга.
Как показано в Таблице 3, многие из ключевых признаков в гамма- и дельта-частотных диапазонах показали значительную корреляцию как с оценкой SRS T, так и с оценкой сенсорного профиля. Самая сильная абсолютная корреляция (R = 0.338) наблюдалась на электроде F7 в дельта-диапазоне. Аналогично, самая высокая статистически значимая корреляция между оценкой сенсорного профиля и агрегированными важными признаками также была обнаружена с электродом F7 в дельта-диапазоне (R = 0.294). Таким образом, несколько признаков из правого и левого заднего квадрантов и лобных областей были последовательно важны и значительно коррелировали с фенотипическими признаками РАС. Это открывает путь для разработки будущих исследований персонализированного лечения путем дальнейшего анализа ассоциации нейронной вариабельности этих областей с поведенческими фенотипами.
Таблица 3. Значения частичной корреляции (R), вычисленные между важными признаками ЭЭГ и оценкой SRS T (верхняя часть) и важными признаками ЭЭГ и оценкой сенсорного профиля (нижняя часть после группировки по каналам электродов монтажа 10–20 (Fp1Cz) и частотным диапазонам в полном наборе данных. Значимые корреляции (p-значение p < 0.05) выделены жирным шрифтом. Пустое поле (–) означает отсутствие важных признаков в этой области, выбранных фреймворком LR. Тест корреляции проводится после корректировки возраста и пола в качестве ковариат. Коррекция Бенджамини-Хохберга используется для корректировки p-значений для множественных сравнений.
Обсуждение
Выявление ЭЭГ-метрик, основанных на механистическом понимании, имеет потенциал открыть новые пути для понимания нейронной динамики, которая формирует сенсорную, внимательную и когнитивную обработку при аутизме. Наши результаты показывают, что межприбыльная вариабельность, динамический нейронный сигнал, обеспечивает большую чувствительность к индивидуальным различиям и более сильные поведенческие корреляции, чем статичные, усредненные по пробам признаки. Предыдущие исследования также подчеркивали, что межприбыльная вариабельность соответствует поведенческой гетерогенности при РАС, делая ее более надежным и индивидуализированным маркером по сравнению со статическими средними (Dong et al., 2024; Easson & McIntosh, 2019; Haigh et al., 2015; Milne, 2011). Это предполагает, что нейронная вариабельность — это не просто шум, а значимое измерение мозговой активности. Такие механистические знания обеспечивают основу для будущих работ, которые интегрируют вариабельность с поведенческими, генетическими данными и данными нейровизуализации для захвата новых измерений индивидуальной нейробиологии.
Помимо непосредственных результатов, наши данные демонстрируют, что межприбыльная вариабельность в машинном обучении (ML) может помочь в классификации РАС с использованием сложных данных ЭЭГ путем выявления важных спектральных признаков. В отличие от традиционных подходов, которые часто испытывают трудности с обработкой больших наборов признаков из-за вычислительных ограничений и риска переобучения, ML использует передовые алгоритмы, которые эффективно анализируют высокоразмерные данные и уменьшают зависимость от обширных этапов предварительной обработки, обучаясь представлениям признаков непосредственно из данных. Это обеспечивает более масштабируемый и адаптивный подход к задачам классификации. В этом исследовании методы ML показали последовательные результаты в повторяющихся тестах валидации. Наш набор данных включал участников из нескольких центров, что добавляет разнообразие как в демографические характеристики участников, так и в условия сбора данных. Несмотря на эти вариации, модели ML достигли высокой точности в выявлении РАС у невиданных ранее участников, что подчеркивает их обобщающую способность. Недавние многоцентровые усилия начали исследовать клинический потенциал диагностики РАС и мониторинга лечения на основе ЭЭГ путем выявления атипичных особенностей мозга и динамики сетей (Rea et al., 2023; Webb et al., 2023) и связывания вариабельности изображений с гетерогенностью симптомов в поведении (Arutiunian et al., 2024; Neuhaus et al., 2021). Наши результаты предполагают, что ML с межприбыльной вариабельностью ЭЭГ предлагает более персонализированную парадигму, которая может помочь в стратификации участников для целенаправленных вмешательств.
Помимо количественной производительности, мы показали, что межприбыльная вариабельность выделяет признаки ЭЭГ, которые соответствуют известным поведенческим вариациям при аутизме. Анализируя веса признаков, изученные моделью, мы обнаружили, что признаки в гамма- и дельта-частотных диапазонах играют ключевую роль в классификации. Последовательное представительство дельта- и гамма-диапазонов среди важных признаков перекликается с предыдущими выводами, связывающими эти диапазоны с атипичными нейронными осцилляциями при РАС (Neo et al., 2023), хотя дальнейшая работа с использованием методов с более высоким пространственным разрешением (например, фМРТ или ЭЭГ с локализацией источника) необходима для более точной локализации этих эффектов. При агрегировании по областям электродов эти признаки показывают заметные ассоциации с оценками SRS, особенно в лобных и задних областях в обоих полушариях, демонстрируя ценность наших выбранных важных признаков. С эмпирической точки зрения, дельта- и гамма-диапазоны демонстрируют низкую корреляцию с другими частотными диапазонами между участниками, как показано на Рис. 4, что может влиять на высокую важность, присвоенную этим признакам моделями ML. В целом, мы наблюдаем, что модель опирается в первую очередь на низкочастотные признаки для принятия решений о классификации, указывая на то, что эти диапазоны предоставляют уникальную информацию, которая может быть полезна для понимания нейронной динамики, связанной с аутизмом, для будущих персонализированных вмешательств.
Возможное ограничение нашего исследования касается влияния немозговых артефактов на показатели вариабельности, полученные с помощью ЭЭГ, особенно в гамма- и дельта-частотных диапазонах. Активность гамма-диапазона подвержена загрязнению мышечной активностью (например, микросаккадами, напряжением челюсти), тогда как низкочастотные дельта-сигналы могут быть затронуты такими факторами, как потливость или медленное смещение электродов (Hallez et al., 2006; Muthukumaraswamy, 2013). Хотя остаточное загрязнение не может быть полностью исключено, в нашем исследовании использовался конвейер предварительной обработки HAPPE v4 (Gabard-Durnam et al., 2018), который включает вейвлет-пороговую ICA, автоматическое отклонение компонентов артефактов (ICLabel) и специализированное удаление мышечных артефактов с помощью MuscIL, что должно учитывать многие из этих немозговых вкладов в наши результаты. Это особенно актуально в контексте биомаркеров, где даже незначительные артефакты могут влиять на выбор признаков моделью. Будущие работы должны включать дополнительные стратегии отклонения артефактов, такие как одновременный мониторинг ЭМГ или продвинутая локализация источников, для дальнейшей проверки мозгового происхождения этих сигналов.
Демографические и нейрокогнитивные факторы важны для понимания наших результатов, признаков ЭЭГ и, как следствие, интерпретации биомаркеров. Хотя в ЭЭГ-части не измерялась напрямую ведущая рука, ее можно было вывести из расположения кнопочной панели в части МРТ. Это подтвердило, что большинство участников были правшами (147/190 правшей, 12 левшей, 1 амбидекстр и 30 неизвестно). Ведущая рука важна, поскольку активность моторной коры и полушарная доминантность могут влиять на сигналы ЭЭГ над центральными электродами, которые у большинства людей покрывают левую первичную моторную кору. У правшей активность C3 может отражать более последовательные моторные и соматосенсорные представления, тогда как у левшей или смешанных людей эти представления могут быть более билатеральными или смещенными, потенциально влияя на паттерны вариабельности мощности. Более того, IQ связан с различиями в скорости когнитивной обработки, контроле внимания и нейронной эффективности, все из которых могут модулировать спектры мощности ЭЭГ и меры вариабельности. Распределение IQ, как показано в Таблице 1, не показало статистически значимой разницы в показателях IQ между группами РАС и TDC (p=7.36). Понимание распределения IQ и ведущей руки в выборке может помочь контекстуализировать обобщаемость наших выводов для более широкой аутистической популяции в будущих исследованиях.
Дальнейшим возможным ограничением настоящего исследования является то, что меры социальной отзывчивости (SRS) и сенсорного профиля могут отражать связанные аспекты аутистического фенотипа. Для уточнения, корреляции вычислялись отдельно для ЭЭГ-SRS (Таблица 3, верхняя часть) и ЭЭГ-сенсорики (Таблица 3, нижняя часть), каждая из которых контролировала пол и возраст. Мы не исключали сенсорные оценки при анализе ЭЭГ-SRS и наоборот, поскольку эти инструменты измеряют комплементарные, но различные измерения симптомов аутизма. SRS оценивает социальное функционирование по подшкалам, таким как социальное осознание, когнитивные способности, коммуникация, мотивация и аутистические манеризмы, в то время как сенсорный профиль охватывает сенсорные домены, включая слуховую, зрительную, тактильную, двигательную, проприоцептивную обработку и связанные с этим поведенческие реакции. Предыдущие работы предполагают, что различия в сенсорной обработке тесно связаны с социальными коммуникативными способностями при аутизме поведенчески (Hilton et al., 2010; Tavassoli et al., 2014; Williams et al., 2018) и нейроразвитийным образом (Marco et al., 2011), в то время как трудности в социальной коммуникации могут усиливать стресс или дискомфорт в сенсорно насыщенных контекстах ((Green et al., 2012)). Анализируя эти взаимосвязи независимо, мы смогли выявить прямые ассоциации между признаками ЭЭГ и каждой поведенческой областью, признавая при этом, что оценки SRS и сенсорного профиля сами по себе коррелируют (R = 0.886), отражая частично общие лежащие в основе механизмы.
Хотя точность классификации примерно 70%, наблюдаемая в этом исследовании, не предназначена в качестве клинически применимого диагностического порога, она, тем не менее, имеет существенную ценность как механистически информативный вывод в многодоменных оценочных фреймворках. Основная цель этой работы — проверить гипотезу, основанную на предыдущих работах по нейронной вариабельности, о том, что межприбыльные флуктуации ЭЭГ улавливают значимые нейробиологические особенности аутизма, которые скрыты традиционными, усредненными по пробам метриками. Систематически количественно оценивая спектральную вариабельность с использованием стандартного отклонения и сравнивая ее со средними признаками в системе кросс-валидации, мы предоставляем эмпирическое расширение «тезиса о нейронной ненадежности» и связанных с ним выводов (Bosl et al., 2011, 2017). Хотя это кажется противоречащим Butler et al. (2017), которые исследовали вариабельность от пробы к пробе в вызванных зрительных и соматосенсорных ответах и не нашли доказательств снижения надежности при РАС, наше исследование затрагивает другой вопрос: вместо того чтобы тестировать каждую метрику вариабельности отдельно, мы использовали многомерный подход, который улавливает информацию, распределенную по множеству частот и областей. В этом контексте мы обнаруживаем, что паттерны вариабельности, особенно в дельта- и гамма-диапазонах, несут информацию, релевантную для диагностической классификации и поведенческих вариаций, даже когда средние групповые различия незначительны. Наблюдаемая точность, которая превышает случайный уровень с использованием множества фреймворков ML, подтверждает мнение о том, что нейронная варибельность отражает воспроизводимое свойство динамики мозга, согласуясь с предыдущими отчетами, связывающими вариабельность с сенсорной чувствительностью, когнитивной согласованностью и гибкостью на уровне цепей (Arutiunian et al., 2024; David et al., 2016; Dinstein et al., 2015; Milne, 2011; Markram et al., 2007; Neuhaus et al., 2021). Более того, было установлено, что межприбыльная вариабельность более информативна, чем признаки AvgTrial или AllTrial, по четырем стандартным классификаторам ML, подчеркивая ее потенциальную полезность в качестве строительного блока для будущих фреймворков.
В этом контексте метрики вариабельности позиционируются не как диагностические инструменты, а как концептуальные и методологические достижения, которые расширяют способы количественного определения нейронных процессов для информирования оценки и лечения при РАС. Интеграция межприбыльной вариабельности в модели машинного обучения и поведенческое фенотипирование может помочь стратифицировать индивидуумов на нейрофизиологически определенные подгруппы. Более того, поскольку вариабельность ЭЭГ может быть измерена во времени, она может поддерживать динамическую корректировку лечения. Например, если она связана с социальной или сенсорной поведенческой обработкой, вариабельность ЭЭГ может служить биомаркером основных механизмов РАС и отслеживать продольные изменения в симптомах. Это может направлять индивидуальное лечение, выявляя, вытекают ли трудности в социальной коммуникации из сенсорной чувствительности или других когнитивных факторов. В фармакологических контекстах вариабельность была связана с ГАМКергической и глутаматергической функцией (Carson IV et al., 2024), предполагая ее полезность в качестве объективного маркера эффектов лекарственного лечения на кортикальную возбудимость. В более широком смысле, включение вариабельности ЭЭГ в клиническое принятие решений может поддержать подход прецизионной медицины, адаптируя вмешательства на основе нейронной обработки, а не только поведения.
Однако требуются дополнительные шаги, прежде чем метрики нейронной варибельности могут быть интегрированы в разработку биомаркеров. Важно будет провести более широкую валидацию на разнообразных популяциях для установления обобщаемости. Параллельное использование с золотыми стандартами фенотипических подходов поможет уточнить их дополнительную ценность в характеристике РАС. Кроме того, изучение того, как вариабельность согласуется с генетическими и другими биологическими маркерами, может обеспечить основу для многодоменных фреймворков. Будущие работы могут включать ЭЭГ с использованием задач, включая обработку речи и реакции на социальную и не-социальную обратную связь, в сочетании с мультимодальной визуализацией для уточнения пространственных интерпретаций и выявления дополнительных паттернов, релевантных для аутизма. Передовые методы машинного обучения, включая рекуррентные нейронные сети (Ali et al., 2021) и трансформеры (Wan et al., 2023), могли бы эффективно обрабатывать межприбыльную вариабельность для предоставления временной информации, необходимой для понимания причинной динамики аутистического мозга. Мы утверждаем, что эти направления могут быть важны для определения того, как метрики, основанные на вариабельности, в конечном итоге могут способствовать более индивидуализированным подходам к оценке и вмешательству.
Заключение
Это исследование подчеркивает потенциал сохранения межприбыльной вариабельности в исследованиях биомаркеров РАС на основе ЭЭГ, рассматриваемый через призму машинного обучения (ML). В частности, использование межприбыльной информации для обучения моделей ML привело к более высокой точности, чем стандартный анализ средних значений, что позволило нам выявить ключевые области мозга, связанные с социальной отзывчивостью. Наши выводы также поддерживают ML как мощный инструмент для связи паттернов мозговой активности с поведенческими характеристиками, связанными с аутизмом. Будущие работы будут изучать ЭЭГ с использованием задач для выявления дополнительных паттернов, связанных с социальной и сенсорной обработкой, в то время как передовые методы глубокого обучения могут лучше улавливать индивидуальные различия. Эти стратегии могут потенциально повысить точность классификации, а также углубить наше понимание нейронных основ аутизма, предлагая новые пути для исследований персонализированного лечения, включая диагностическую стратификацию, фенотипирование и выявление групп, релевантных для лечения.