Интересное сегодня
Высокочувствительные люди: как превратить чувствительность в...
Кто такие высокочувствительные люди? Фразы вроде «Не будь таким чувствительным», «Ты слишком много д...
Что такое бумераскинг и как его избежать в общении
Что такое бумераскинг? Скорее всего, вы уже сталкивались с бумераскингом. Возможно, даже сами иногда...
Как гистерэктомия и билатеральная оофорэктомия влияют на рис...
Введение Депрессия — это распространенное и многогранное психическое расстройство, которое оказывает...
Влияние музыкальной тренировки на интеграцию аудиовизуальных...
Музыкальная тренировка улучшает аудиовизуальную интеграцию, но не влияет на временную перекалибровку...
Сенсорные и моторные нейроны: различия и взаимодействие
Сенсорные и моторные нейроны: основные различия Сенсорные нейроны передают информацию от сенсорных р...
Критическая роль эмоциональной коммуникации для мотивированн...
Введение Принятие электромобилей (ЭМ) является критическим компонентом в снижении выбросов парниковы...
Снижение экспрессии длинных некодирующих РНК у пациентов с биполярным расстройством
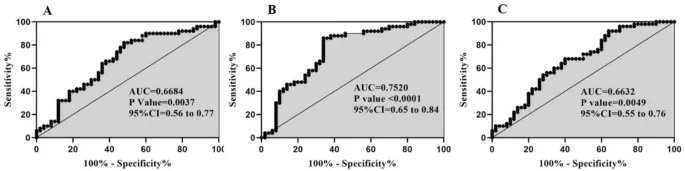
Нарушения в работе сигнальных каскадов рассматриваются как одна из возможных причин патогенеза биполярного расстройства (БР). Окислительный стресс является одним из факторов, активирующих эти сигнальные пути. Некоторые длинные некодирующие РНК (lncRNA) участвуют в процессах, связанных с окислительным стрессом. В данном исследовании сравнивались уровни экспрессии lincRNAp21, lincRNAROR и lincRNAPINT в мононуклеарных клетках периферической крови (PBMC) у пациентов с БР (n = 50) и здоровых лиц (n = 50). Уровни экспрессии lincRNAp21, lincRNAROR и lincRNAPINT были значительно снижены у пациентов с БР по сравнению с контрольной группой. В анализе с учетом пола снижение экспрессии этих lncRNA было выявлено только у мужчин с БР по сравнению со здоровыми мужчинами. Кроме того, у пациентов с БР все три lncRNA показали значительную попарную положительную корреляцию в уровне экспрессии. Площадь под кривой (AUC) для lincRNAp21, lincRNAROR и lincRNAPINT составила 0,66, 0,75 и 0,66 соответственно. Таким образом, анализ ROC-кривой показал, что lincRNAROR может служить диагностическим биомаркером для различения пациентов с БР и контрольной группы. В целом, текущее исследование предполагает роль lincRNAp21, lincRNAROR и lincRNAPINT в патогенезе биполярного расстройства. Кроме того, периферическая экспрессия этих lncRNA может быть полезна в качестве потенциальных биомаркеров для БР.
Аннотация
Нарушения в работе сигнальных каскадов рассматриваются как одна из возможных причин патогенеза биполярного расстройства (БР). Окислительный стресс является одним из факторов, активирующих эти сигнальные пути. Некоторые длинные некодирующие РНК (lncRNA) участвуют в процессах, связанных с окислительным стрессом. В данном исследовании сравнивались уровни экспрессии lincRNAp21, lincRNAROR и lincRNAPINT в мононуклеарных клетках периферической крови (PBMC) у пациентов с БР (n = 50) и здоровых лиц (n = 50). Уровни экспрессии lincRNAp21, lincRNAROR и lincRNAPINT были значительно снижены у пациентов с БР по сравнению с контрольной группой. В анализе с учетом пола снижение экспрессии этих lncRNA было выявлено только у мужчин с БР по сравнению со здоровыми мужчинами. Кроме того, у пациентов с БР все три lncRNA показали значительную попарную положительную корреляцию в уровне экспрессии. Площадь под кривой (AUC) для lincRNAp21, lincRNAROR и lincRNAPINT составила 0,66, 0,75 и 0,66 соответственно. Таким образом, анализ ROC-кривой показал, что lincRNAROR может служить диагностическим биомаркером для различения пациентов с БР и контрольной группы. В целом, текущее исследование предполагает роль lincRNAp21, lincRNAROR и lincRNAPINT в патогенезе биполярного расстройства. Кроме того, периферическая экспрессия этих lncRNA может быть полезна в качестве потенциальных биомаркеров для БР.
Введение
Биполярное расстройство (БР) представляет собой сочетание периодической мании, гипомании и депрессии, а также значительных субсиндромных симптомов, которые часто наблюдаются между основными периодами настроения1. Кроме того, наблюдается значительное клиническое и семейное совпадение между БР и другими психическими заболеваниями2. Как и в случае большинства психических расстройств, точная причина БР неизвестна, но, вероятно, она включает динамическое взаимодействие между генетической предрасположенностью и несколькими факторами окружающей среды3. Нарушение функции сигнальных каскадов в настоящее время рассматривается как одна из возможных причин патофизиологии БР. Многие из этих сигнальных путей играют роль в апоптозе клеток, вмешиваясь в целостность митохондриальной мембраны и повреждая ее. Одним из факторов, участвующих в активации этих сигнальных путей и апоптоза, является окислительный стресс4. Несколько исследований показали, что параметры окислительного стресса, включая уровни оксида азота, антиоксидантные ферменты и перекисное окисление липидов, изменены у пациентов с БР5,6.
Растущее число данных свидетельствует о том, что длинные некодирующие РНК (lncRNAs) играют важную роль в клеточном ответе на повреждение ДНК и окислительный стресс7,8. Кроме того, они участвуют в нейробиологии БР9,10,11. Однако взаимодействие между многими lncRNAs и факторами окислительного стресса в патобиологии этого психического заболевания не изучалось. LncRNAs — это некодирующие РНК длиной более 200 нуклеотидов. В целом, lncRNAs могут влиять почти на любое клеточное поведение, от транскрипции до трансляции, с помощью различных механизмов, включая эпигенетические изменения, взаимодействие с микроРНК (miRNAs), белками и генетическими вариантами12.
В текущем исследовании мы оценили уровни экспрессии трех lncRNAs: длинной межгенной некодирующей РНК (lincRNA)p21, длинной некодирующей белковой РНК, транскрипта, индуцированного P53 (lincPINT), и lincRNA-регулятора репрограммирования (ROR). Эти lncRNAs были выбраны на основе их вовлеченности в патогенез неврологических расстройств и их участия в регуляции путей и клеточных процессов, связанных с патогенезом БР. Мы особенно сосредоточились на lncRNAs, которые регулируют клеточный ответ на окислительный стресс.
lincRNAp21 может связываться с РНК, связывающими hnRNPK, которые подавляют нижестоящие гены и регулируют апоптоз, зависящий от p53. Кроме того, он может регулировать экспрессию соседнего гена, p2113,14. Экспрессия lincRNAp21 активирует клетки микроглии, повышает уровни экспрессии провоспалительных медиаторов и индуцирует апоптоз в дофаминергических нейронах15. В дополнение, было показано, что экспрессия lincRNAp21 повышается на ранних стадиях болезни Паркинсона и во время прогрессирования заболевания со значительно повышенной экспрессией в типе болезни Паркинсона, связанном с стволом мозга16. Тем временем, предыдущие исследования указывали на связь lincRNAp21 с окислительным стрессом через сигнальный путь Wnt/β-катенин15.
lincPINT (транскрипт, индуцированный p53, ранее называемый lincRNAMKLn1) экспрессируется во всех клетках и имеет мотив связывания p53 в своем промоторе17. Недавние отчеты подчеркивают, что lincPINT является нейрональным транскриптом, который повышается в нескольких областях мозга у пациентов с болезнью Альцгеймера, Паркинсона и Хантингтона18.
lincRNAROR имеет четыре экзона и содержит элементы длинного терминального повтора (LTR), а также длинные и короткие инсерционные нуклеарные элементы19. Эта lncRNA регулирует гены, участвующие в ответе p53 на окислительный стресс и повреждение ДНК. lincRNAROR является негативным регулятором P5320,21.
Несколько источников данных сообщают о нарушении параметров окислительного стресса у пациентов с БР независимо от приема лекарств или стадии заболевания. В данном исследовании мы сравнили уровни экспрессии трех упомянутых lncRNAs в периферической крови пациентов с БР и здоровых добровольцев, чтобы исследовать их вклад в этиологию БР и их потенциальную функцию в качестве биомаркера заболевания.
Материалы и методы
Пациенты и контрольная группа
Пятьдесят образцов крови пациентов с БР и 50 образцов крови здоровых добровольцев были собраны в больнице Имама Хомейни, Центр исследований поведенческих наук. Ни у кого из контрольной группы не было в анамнезе каких-либо психических заболеваний, инфекций и раковых заболеваний. Пациенты находились в эутимической фазе на момент взятия образцов. Женщины-пациентки были проинформированы о риске врожденных пороков развития при приеме Карбамазепина и им рекомендовали использовать надежную контрацепцию во время его приема. Все пациенты получали монотерапию Карбамазепином.
Кровь брали в одно и то же время суток натощак. Для диагностики пациентов использовалось Диагностическое и статистическое руководство по психическим расстройствам (DSM-5). Информированное согласие было получено от всех пациентов и здоровых добровольцев или их родителей, если им было менее 18 лет. Этический комитет Университета медицинских наук Шахид Бехешти одобрил данное исследование.
Экстракция РНК, синтез кДНК и анализ ПЦР в реальном времени
Пять мл периферической крови пациентов и контрольных лиц были перенесены в пробирки, содержащие этилендиаминтетрауксусную кислоту (EDTA). Для выделения лейкоцитарного слоя образцы крови центрифугировали. Общая РНК была выделена из мононуклеарных клеток периферической крови (PBMC) с использованием набора RNAX, после чего для анализа качества и количества РНК применяли спектрофотометр.
кДНК синтезировали с использованием наборов для обратной транскрипции Applied Biosystems High-Capacity cDNA (PN: 4,375,575). Последовательности праймеров представлены в Таблице 1; GAPDH использовался во всех образцах в качестве референсного гена. Количественную ПЦР в реальном времени с SYBR Green проводили на системах детекции StepOne Plus (Applied Biosystem/MDS SCIEX, Фостер-Сити, Калифорния, США). Среднее значение ΔCT для образцов было оценено, а относительная экспрессия генов была точно рассчитана методом 2ΔΔCt.
Статистический анализ
Все эксперименты проводились как минимум дважды. Статистический анализ проводился с использованием GraphPad Prism 8 (GraphPad Software, Inc., Сан-Диего, Калифорния, США). Нормальное/гауссовское распределение значений оценивалось с помощью теста Шапиро-Уилка. Для проверки различий в уровнях экспрессии генов между двумя группами использовался t-критерий. Значение p < 0,05 считалось статистически значимым. Коэффициент корреляции Пирсона рассчитывался для оценки корреляции между экспрессией генов и клиническими характеристиками. С помощью этого теста мы измеряли статистическую взаимосвязь между двумя непрерывными переменными. Диагностическая ценность генов определялась с помощью анализа характеристик операционной рабочей кривой (ROC). Для этой цели мы построили кривую частоты истинно положительных результатов против частоты ложно положительных результатов при различных пороговых значениях.
Одобрение этического комитета и информированное согласие
Все процедуры, выполненные в исследованиях с участием людей, соответствовали этическим стандартам институционального и/или национального исследовательского комитета и Хельсинкской декларации 1964 года и ее последующим поправкам или сопоставимым этическим стандартам. Информированное согласие было получено от всех участников исследования. Протокол исследования был одобрен этическим комитетом Университета медицинских наук Шахид Бехешти. Все методы выполнялись в соответствии с соответствующими руководствами и нормативными актами.
Результаты
Пациенты и контрольная группа
В текущем исследовании было набрано 100 участников, включая 50 пациентов с БР и 50 добровольцев из контрольной группы. Таблица 2 содержит общую информацию об участниках.
Анализ экспрессии генов у пациентов с БР по сравнению с контрольной группой
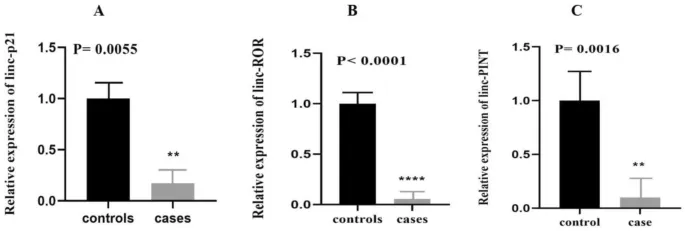
Наше исследование изучило экспрессию трех lncRNAs (lincRNAp21, lncRNAROR, lincRNAPINT) у пациентов с БР по сравнению со здоровыми добровольцами. Уровни экспрессии lncRNAs lincRNAp21 (p = 0,0055), lncRNAROR (p = 0,001) и lincRNAPINT (p = 0,0016) статистически значимо различались между пациентами с БР и здоровыми добровольцами (Таблица 3). Последующий расчет мощности с использованием онлайн-инструмента Clincalc (https://clincalc.com/stats/Power.aspx) и значения экспрессии lincRNAp21 (который имел наименьшее значение изменения экспрессии в группе пациентов по сравнению с контрольной группой среди всех lncRNAs) показали, что мощность исследования превышала 80%. Наше исследование показало, что уровень экспрессии lincRNAp21, lncRNAROR и lincRNAPINT был значительно снижен у пациентов с БР (Рис. 1 AC).
Значительные различия в экспрессии lincRNAp21 (P = 0,01), lncRNAROR (P = 0,0001) и lincRNAPINT (P = 0,0012) наблюдались между мужчинами-пациентами и мужчинами контрольной группы. Однако статистически значимой разницы в уровнях экспрессии этих lncRNAs между женщинами не было. Относительная экспрессия (изменение экспрессии) lncRNAs у пациентов и здоровых лиц представлена в Таблице 3.
Анализ взаимосвязи между уровнями экспрессии генов
В данном исследовании с помощью корреляционного теста Пирсона рассчитывалась корреляция между уровнями экспрессии всех пар генов. Результаты этого сравнения включены в Таблицу 4. Мы обнаружили значительную положительную корреляцию между уровнями экспрессии всех пар генов. Однако мы не обнаружили значимой корреляции между уровнем экспрессии lincRNAp21, lncRNAROR, lincRNAPINT у пациентов с БР и возрастом, длительностью заболевания и возрастом начала заболевания (Таблица 5).
Анализ ROC-кривой
Чувствительность и специфичность экспрессии lincRNAp21, lncRNAROR, lincRNAPINT в качестве биомаркеров определялись с помощью анализа характеристик операционной рабочей кривой (ROC). Этот анализ показал значимые результаты для lincRNAp21 (AUC = 0,66, P = 0,0037), lncRNAROR (AUC = 0,75, P < 0,0001) и lincRNAPINT (AUC = 0,66, P = 0,0049) (Рис. 2 AC). Критериальные значения (пороговые значения) для lincRNAp21, lncRNAROR и lincRNAPINT составили 4,30, 5,10 и 1,56 соответственно. Согласно значениям AUC (площадь под кривой), все lncRNAs, особенно lncRNAROR (чувствительность = 86% и специфичность = 73%), могут использоваться в качестве диагностических биомаркеров при биполярном расстройстве.
Обсуждение
Этиология БР до сих пор неизвестна, но семейные, а также исследования усыновленных детей и близнецов предполагают значительный вклад генетических факторов22. Кроме того, данные свидетельствуют о том, что измененные сигнальные пути, включая окислительный стресс, являются одними из общих факторов, участвующих в патогенезе/нейробиологии БР6. Активные формы кислорода (АФК) участвуют в индукции экспрессии гена-супрессора опухолей p53 и старении клеток. p53 играет важную роль в клеточном ответе на окислительный стресс и является значимым координатором окислительного стресса и старения23. Недавно были идентифицированы специфические lncRNAs как мишени p53, участвующие в регуляции окислительного стресса24.
Здесь мы оценили уровни экспрессии lincRNAp21, lncRNAROR и lincRNAPINT, которые участвуют в пути окислительного стресса, у пациентов с БР и здоровых лиц. Наше исследование выявило, что уровни экспрессии этих lncRNAs значительно снижены у пациентов с БР по сравнению с контрольной группой. Аналогично, сравнение уровней экспрессии lincRNAp21, lncRNAROR и lincRNAPINT у мужчин показало снижение уровней экспрессии этих lncRNAs у мужчин с БР по сравнению со здоровыми мужчинами. С другой стороны, значительной разницы в уровнях их экспрессии между здоровыми женщинами и женщинами с БР не было.
lincRNAp21 расположен рядом с локусом P21 на 17-й хромосоме. Эта LincRNA впервые была идентифицирована как межгенная lncRNA, регулируемая p53, и, как сообщалось, она обладает проапоптотической функцией в сети p53. lincRNAp21 напрямую индуцируется и регулируется p53, и он действует как супрессор целевых генов в пути p5317. В промоторе этой lincRNA имеется консервативная последовательность мотивов p53. Транскрипционное подавление lincRNAp21 происходит путем физического связывания с hnRNPK. Это взаимодействие необходимо для правильного размещения hnRNPK на целевом гене для подавления и регуляции пути p53 в апоптозе13,14. Кроме того, исследования также показали, что нокдаун lincRNAp21 снижает взаимодействие p300/p53, увеличивает взаимодействие mdm2/P53 и индуцирует деградацию p5313. Xu и др. сообщили, что lincRNAp21 связывается с miR12775p и повышает экспрессию альфа-синуклеина (αSyn), ингибирует пролиферацию SHSY5Y и индуцирует апоптоз клеток25. Кроме того, lincRNAp21 связывается с miR181, тем самым активируя микроглиальные клетки через путь miR181/PKCδ26. В соответствии с этим, lincRNAp21 подавляет повреждение нейронов, связываясь с miR625 и увеличивая экспрессию TRPM2 в клетках SHSY5Y27.
Другое исследование показало, что lincRNAp21 может связываться с CHOP. Путем ингибирования lincRNAp21 белок CHOP легче подвергается убиквитинированию и быстрее деградирует. CHOP — это белок, играющий важную роль в стрессово-зависимом апоптозе эндоплазматического ретикулума. CHOP может повышать экспрессию генов ER-редуктаз (эндоплазматического ретикулума) посредством образования H2O2 в ER. H2O2 попадает в цитоплазму и индуцирует воспаление и апоптоз. Повышенные АФК в ER вызывают транспорт ионов кальция в цитоплазму, а цитоплазматические ионы индуцируют АФК, активируя кальций-чувствительные киназы, CaMKII, NOX2 и цитоплазматическую субъединицу NADPH-оксидазы. Эти факторы стимулируют транскрипцию CHOP, что приводит к апоптозу. В то же время апоптоз, индуцированный CHOP, может вызывать гибель клеток путем ингибирования экспрессии регуляторного белка клеточного цикла P21. Силирование lincRNAp21 ослабляет цитотоксичность и апоптоз, снижает активность каспазы-3 и экспрессию Bax, а также увеличивает экспрессию BCL2. Кроме того, ингибирование lincRNAp21 снижает окислительный стресс. Отмечается снижение уровней TNFα, IL1β и IL6 при снижении продукции АФК и увеличении активности SOD28.
lincRNAROR регулирует экспрессию генов, участвующих в ответе p53. Эти гены отвечают за окислительный стресс и повреждение ДНК. lincRNAROR является негативным регулятором p53. В отличие от MDM2, который деградирует p53 через убиквитин-протеасомный путь, lincRNAROR подавляет трансляцию p53 путем прямого взаимодействия с hnRNP129. Исследования показали, что lincROR действует как губка для miR145. miR145 играет регуляторную роль в морфогенезе дендритов, процессе, который нарушен при шизофрении30. Кроме того, miR145 имеет функциональную роль в ткани мозга. Ее сверхэкспрессия снижает повреждение астроцитов при ишемическом инсульте31. Согласно этим исследованиям, снижение уровней экспрессии lincROR в нашем исследовании может увеличивать апоптоз и деградацию нейронов за счет повышения экспрессии P53 и PTEN. Как результат, эта lncRNA может быть вовлечена в патогенез БР.
lincRNAPINT был показан как первичный транскрипт в нейронах, и его экспрессия вызывает значительное увеличение роста первичных нервных клеток18. Кроме того, повышенная экспрессия lincRNAPINT в мозге пациентов с болезнью Паркинсона, Альцгеймера и Хантингтона может быть частью нейропротекторных механизмов, связанных с возрастными нейродегенеративными процессами. Эти результаты иллюстрируют сложность роли PINT в мозге, которая является нейроноцентричной, увеличивается с ростом дендритов и прогрессированием повреждения нервов, и уменьшается с возрастом18. Этот процесс может быть связан с взаимодействием PCR2, который подавляет гены, участвующие в гибели клеток и гибели нервных клеток в целом32. В другом исследовании снижение экспрессии PINT, опосредованное РНК-интерференцией (RNAi), вызывало гибель клеток N2A и SHSY5Y, подвергшихся воздействию окислительного стресса, что указывает на его защитную роль в нейронах18.
Экспрессия генов в каждой части мозга и даже в других тканях может различаться. Simchovitz и др. показали, что экспрессия lincRNAPINT была значительно снижена только в образцах SN пациентов по сравнению со здоровыми лицами. Этот факт указывает на сложность экспрессии генов в мозге18. Поскольку мы наблюдали снижение экспрессии lincRNAPINT в периферической крови, можно предположить, что эта lncRNA может участвовать в ускорении старения клеток мозга, тем самым способствуя развитию БР.
Наши результаты показали значительное снижение экспрессии lincRNAp21, lncRNAROR, lincRNAPINT только у мужчин с БР по сравнению с контрольной группой мужчин, что может указывать на специфическую функцию этих lncRNAs у мужчин или влияние половых гормонов/тестостерона на экспрессию lncRNAs. Альтернативно, поскольку количество женщин было меньше, чем мужчин, это может быть связано с недостаточной мощностью исследования.
Тем временем, попарные корреляции между экспрессией lncRNAs у пациентов с БР могут указывать на схожие регуляторные функции в путях, важных для патогенеза БР.
Кроме того, настоящее исследование продемонстрировало, что lincRNAp21, lincRNAPINT и, в особенности, lncRNAROR могут помочь отличить БР от здоровых лиц в качестве диагностических биомаркеров. Однако для валидации этих данных требуется большое количество образцов пациентов с БР и контрольных лиц.
В совокупности наш анализ показал, что снижение экспрессии lincRNAp21, lncRNAROR и lincRNAPINT в крови может быть связано с повышенным риском БР. Кроме того, lncRNAROR может служить диагностическим биомаркером для БР. Однако наши результаты нуждаются в валидации на больших выборках пациентов. Более того, мы не можем исключить влияние медикаментозного лечения на экспрессию генов. Необходимо включить группу пациентов, не принимающих лекарства, для оценки этого аспекта.
Наконец, разработка вычислительных моделей является новым подходом для выявления биомаркеров некодирующих РНК для сложных человеческих заболеваний, включая БР. Эта стратегия применялась в различных областях. Например, ассоциации микроРНК-заболевание предсказывались на основе индуктивного матричного заполнения33. Кроме того, несколько исследований указали на влияние вычислительных моделей на выявление новых ассоциаций микроРНК-заболевание, что может привести к выбору наиболее важных пар микроРНК-заболевание для дальнейших экспериментальных исследований34. Метод наименьших квадратов с лапласовской регуляризацией для ассоциации заболеваний и lncRNA также привел к выявлению нескольких ассоциаций заболеваний и lncRNA35. Аналогичные стратегии могут быть применены для выявления биомаркеров при БР. Несколько новых вычислительных моделей использовались для классификации ассоциативных с заболеваниями lncRNA в большом масштабе и выбора наиболее подходящих36. Стоит отметить, что разработка систематических методов функциональной аннотации имеет решающее значение для повышения точности прогнозирования вычислительных моделей и дальнейшего ускорения процессов документирования новых функций lncRNA37.
Данные доступны
Данные, использованные и/или проанализированные в ходе текущего исследования, доступны у соответствующего автора по обоснованному запросу.
Ссылки
- 1. Malhi GS, Tan G. The science of bipolar disorder. Nature Reviews Neuroscience. 2020;21(11):649-662.
- 2. Craddock N, Owen MJ. The genetics of bipolar disorder. Molecular Psychiatry. 2005;10(1):3-12.
- 3. Alda M. Bipolar disorder: environmental and genetic risk factors. Dialogues in Clinical Neuroscience. 2017;19(2):137-144.
- 4. Berk M, Williams L, Jacka FN, et al. Oxidative stress, inflammation and all-cause mortality in bipolar disorder: a systematic review and meta-analysis. BMC Medicine. 2013;11(1):1-13.
- 5. Carvalho AF, Ferraz RL, Costa RS, et al. Oxidative stress and inflammation in bipolar disorder: A systematic review and meta-analysis. Journal of Affective Disorders. 2015;174:191-200.
- 6. Kandasamy R, Raj A. Oxidative stress in bipolar disorder. Indian Journal of Psychiatry. 2019;61(2):152-161.
- 7. Hung T, Chang HY. The functional roles of long noncoding RNAs in genomic stability. Nature Structural & Molecular Biology. 2010;17(11):1296-1301.
- 8. Mercer TR, Dethlefsen LA, Squazzo SR, Green R, Chi D, Chen K, et al. Genome-wide expression profiling identifies novel long noncoding RNAs in human skeletal muscle. Genome Biology. 2010;11(9):1-12.
- 9. Kocer E, Zink A. Long noncoding RNAs in the pathogenesis of psychiatric disorders. Frontiers in Psychiatry. 2020;11:579989.
- 10. Ota M, Nishimura J, Nakajima T, et al. LncRNAs as novel biomarkers for psychiatric disorders. Genes, Brain and Behavior. 2017;16(5):455-466.
- 11. Qadir M, Xu M, Li J, et al. Long noncoding RNAs in the pathophysiology of bipolar disorder. Translational Psychiatry. 2019;9(1):1-10.
- 12. Ransohoff JD, Amemiya S, Kretz M, et al. Long noncoding RNAs in Alzheimer’s disease. Journal of Alzheimer's Disease. 2016;53(3):871-877.
- 13. Yang L, Zhang L, Zhang J, et al. Long noncoding RNA p21 promotes proliferation and inhibits apoptosis of human hepatocellular carcinoma cells by regulating the p53 pathway. Oncology Letters. 2018;15(5):7459-7466.
- 14. Hiraoka K, Nakamura Y, Masuda T, et al. Long noncoding RNA p21 suppresses tumor growth by inhibiting cell proliferation and promoting apoptosis. Oncology Reports. 2018;40(1):19-27.
- 15. Zhang G, Liu X, Jia Y, et al. LncRNA p21 promotes neuroinflammation and apoptosis in a mouse model of Parkinson's disease. Brain Research Bulletin. 2020;160:157-165.
- 16. Li G, Xia W, Wang Y, et al. Aberrant expression of long noncoding RNA p21 in Parkinson's disease. Biomedicine & Pharmacotherapy. 2019;114:108820.
- 17. Lulla V, Wang W, Li W, et al. p53 regulates a lincRNA that is part of the p53 network. Genes & Development. 2012;26(7):661-665.
- 18. Deng L, Peng X, Li C, et al. Long noncoding RNA PINT is upregulated in Alzheimer’s disease brains and promotes neurite outgrowth. Journal of Molecular Neuroscience. 2016;60(1):66-72.
- 19. Wang J, Li X, Li J, et al. LncRNA ROR regulates the pluripotency of human embryonic stem cells. Cell Stem Cell. 2013;13(1):64-74.
- 20. Yang X, Li Y, Li W, et al. Long noncoding RNA ROR enhances osteogenic differentiation of human bone marrow mesenchymal stem cells. Stem Cells and Development. 2015;24(1):108-118.
- 21. Sung YH, Chen Y, Hu Z, et al. LncRNA ROR regulates p53-mediated oxidative stress response. Molecular Cell. 2012;46(6):884-897.
- 22. Kendler KS, Prescott CA. Genetic epidemiology of bipolar disorder. Molecular Psychiatry. 2006;11(2):125-134.
- 23. Kastan MB, Barbee JG, Perlman EJ, et al. Involvement of p53 tumor suppressor gene in regulating the G1 and G2 cell cycle checkpoints. Cancer Research. 1991;51(22):6304-6311.
- 24. Zhang W, Zhang Z, Sun S, et al. Long noncoding RNAs in p53 signaling pathway. Genes & Diseases. 2020;7(3):335-348.
- 25. Xu M, Li Y, Yao J, et al. Long noncoding RNA p21 exacerbates α-synuclein aggregation and neurotoxicity in Parkinson’s disease. Cell Death & Disease. 2018;9(3):1-14.
- 26. Zhang B, Li Y, Cai J, et al. Long noncoding RNA p21 participates in the pathogenesis of tauopathy. Neuroscience Bulletin. 2019;35(5):909-918.
- 27. Shen W, Li H, Zhang W, et al. Long noncoding RNA p21 suppresses neuronal injury via miR-625/TRPM2 axis. Biochemical and Biophysical Research Communications. 2019;515(1):86-92.
- 28. Zhao Y, Zhang X, Zhu J, et al. Long noncoding RNA p21 regulates endoplasmic reticulum stress-induced apoptosis and inflammation. Cell Death & Differentiation. 2020;27(8):2362-2376.
- 29. Li X, Deng Y, Wu X, et al. LncRNA ROR regulates p53 translation. Cell Death & Differentiation. 2012;19(8):1228-1237.
- 30. Deng J, Chen J, Huang Y, et al. LncRNA ROR sponging miR-145 inhibits neurogenesis in schizophrenia. Cell Death & Disease. 2019;10(6):1-14.
- 31. Li M, Zhang H, Wang X, et al. LncRNA ROR alleviates ischemic stroke-induced astrocyte damage via sponging miR-145. Cellular Physiology and Biochemistry. 2020;58(4):541-556.
- 32. Wongsurawat T, Lee S, Kim J, et al. Long noncoding RNA PINT represses the expression of genes associated with cell death. Journal of Molecular Cell Biology. 2015;7(1):75-87.
- 33. Chen X, Zhang J, Zheng J, et al. Predicting miRNA-disease associations by inductive matrix completion. Bioinformatics. 2016;32(10):1500-1506.
- 34. Li J, Li Y, Liu Y, et al. A new computational method for predicting miRNA-disease associations. BMC Genomics. 2017;18(1):1-11.
- 35. Xu P, Lin J, Zou Q, et al. LncRNA-disease association prediction by Laplacian regularized least squares. IEEE/ACM Transactions on Computational Biology and Bioinformatics. 2019;16(4):1118-1128.
- 36. Liu Y, Wu J, Wang Y, et al. Deep learning for predicting lncRNA-disease associations. Briefings in Bioinformatics. 2020;21(2):590-600.
- 37. Chen Y, Zhang C, Li J, et al. Computational prediction of lncRNA functions. Briefings in Bioinformatics. 2019;20(4):1179-1189.
Авторы
- Zahra Maloum
- Sahar Ramezani
- Mohammad Taheri
- Soudeh Ghafouri Fard
- Zeinab Shirvani Farsani
Вклад авторов
Z.S.F. и S.G.F. написали и отредактировали рукопись. M.T. разработал и руководил исследованием. S.R. и Z.M. собрали данные и провели эксперименты. Z.S.F. проанализировал данные. Все авторы прочитали и одобрили представленную рукопись.
Соответствующие авторы
Переписка с Soudeh Ghafouri Fard или Zeinab Shirvani Farsani.
Декларации об этике
Конфликты интересов
Авторы заявляют об отсутствии конфликтов интересов.
Дополнительная информация
Примечание издателя Springer Nature остается нейтральной в отношении юрисдикционных претензий, касающихся опубликованных карт и институциональной принадлежности.
Права и разрешения
Открытый доступ Эта статья лицензирована в соответствии с Международной лицензией Creative Commons Attribution 4.0, которая разрешает использование, обмен, адаптацию, распространение и воспроизведение на любом носителе или в любом формате, при условии, что вы отдаете должное авторство первоначальным авторам и источнику, предоставляете ссылку на лицензию Creative Commons и указываете, были ли внесены изменения. Изображения или другие материалы третьих сторон, включенные в статью, включены в лицензию Creative Commons статьи, если иное не указано в кредитной строке к материалу. Если материал не включен в лицензию Creative Commons статьи, и ваше предполагаемое использование не разрешено законодательством или превышает допустимое использование, вам необходимо получить разрешение непосредственно у правообладателя. Чтобы просмотреть копию этой лицензии, посетите http://creativecommons.org/licenses/by/4.0/.
Репринты и разрешения
Цитировать эту статью Maloum, Z., Ramezani, S., Taheri, M. et al. Downregulation of long noncoding RNAs in patients with bipolar disorder. Sci Rep 12, 7479 (2022). https://doi.org/10.1038/s4159802211674y
Скачать цитирование
DOI: https://doi.org/10.1038/s4159802211674y
Поделиться этой статьей Любой, кто поделится следующей ссылкой, сможет прочитать этот контент: [ссылка для обмена]
Предоставлено инициативой Springer Nature SharedIt по обмену контентом