Интересное сегодня
Окситоцин: как «гормон любви» защищает женщин от перепадов н...
Окситоцин как защитник женского настроения Новое исследование предполагает, что окситоцин, так назыв...
Можно ли использовать тематический анализ для анкет? Полное ...
Можно ли использовать тематический анализ для анкет? Да, тематический анализ может быть ценным инстр...
Гибкий график работы: как пандемия изменила баланс между сем...
Как пандемия изменила подход к работе Сейчас трудно поверить, но пандемия COVID-19 началась всего че...
Эффективность реформер-пилатеса при хронической боли: исслед...
Введение Мышечно-скелетные нарушения представляют собой глобальную проблему здравоохранения, вызываю...
Исследование социального интеллекта больших языковых моделей...
Растущая повсеместность искусственного интеллекта (ИИ) в приложениях быстро меняет повседневную жизн...
Различия между обычными, осознанными снами и внетелесным опы...
Введение в природу сновидений Сновидение представляет собой сложное и интригующее явление, возникающ...
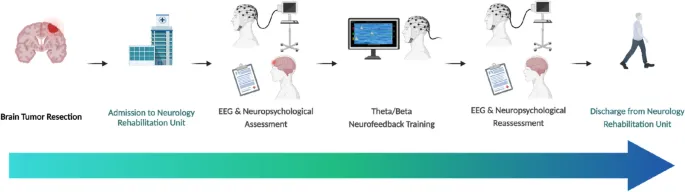
Новые подходы к восстановлению после удаления опухолей головного мозга: Сочетание нейрофидбэка и моторной реабилитации
В последние десятилетия наблюдается существенный рост заболеваемости, связанной с онкологическими заболеваниями. Опухоли головного и центральной нервной системы (ЦНС) представляют собой особенно тяжелую подгруппу. Только в 2024 году в Западной Европе ожидается более 40 000 случаев опухолей ЦНС, что сопоставимо с тенденциями в Соединенных Штатах. Особенно тревожна ситуация среди подростков и молодых взрослых, где первичные опухоли головного мозга являются одной из ведущих причин смерти от рака. Несмотря на успехи в онкологии, приводящие к увеличению выживаемости, значительное число пациентов сталкивается с долгосрочными неврологическими последствиями как самой болезни, так и ее лечения.
Влияние опухолей головного мозга на функции
Опухоли головного мозга нарушают нормальную архитектуру и функции мозга, часто приводя к двигательным нарушениям (например, слабости, атаксии, спастичности) и когнитивным дефицитам (например, нарушениям внимания, памяти, речи и исполнительных функций). Нейрохирургическое удаление может усугубить эти нарушения из-за сопутствующего повреждения, отека или нарушения функционально значимых областей. Даже обширные резекции, особенно проведенные в условиях бодрствования, могут привести к временному послеоперационному снижению внимания, даже у пациентов с хорошим дооперационным когнитивным профилем. Это подчеркивает необходимость комплексных подходов к нейрореабилитации, учитывающих специфические уязвимости в подострой фазе.
В этом контексте ранняя и интенсивная двигательная реабилитация имеет решающее значение, поскольку она значительно улучшает двигательные функции, самостоятельность при ходьбе и повседневную активность у пациентов с постоперационными двигательными дефицитами. Исследования показывают, что ранняя и интенсивная физическая терапия связана с улучшением функциональных исходов и усилением нейропластичности, способствуя реорганизации двигательных цепей и снижению долгосрочной инвалидизации.
Нейрофидбэк: новый инструмент в реабилитации
Среди новых методов лечения нейрофидбэк (NF) привлек внимание как неинвазивная нейромодуляторная техника, способная улучшить когнитивные и моторные результаты у различных клинических групп. Предоставляя обратную связь в режиме реального времени на основе данных электроэнцефалографии (ЭЭГ), NF позволяет людям модулировать специфические нейронные ритмы, используя механизмы геббовской и гомеостатической пластичности. Многообещающие результаты были получены при таких состояниях, как инсульт, черепно-мозговая травма и нейродегенеративные заболевания. Однако применение NF у пациентов, перенесших онкологические заболевания ЦНС, все еще находится на ранних стадиях.
Недавний систематический обзор подчеркнул ограниченные, но растущие данные, подтверждающие эффективность когнитивных реабилитационных (CR) методов, включая NF, у пациентов, перенесших опухоли головного мозга. Хотя целостные мнемонические тренировки и видео-НФ показали смешанные результаты, некоторые исследования сообщили об улучшениях исполнительных функций, саморегуляции и качества жизни, особенно среди молодых и более образованных пациентов. Несмотря на методологическую вариативность, эти результаты предполагают, что протоколы CR, включающие NF, могут иметь терапевтический потенциал при индивидуализации под профили пациентов.
Потенциал NF у пациентов с повреждениями головного мозга более широко изучался вне онкологии. Систематический обзор протоколов NF при приобретенных повреждениях головного мозга (ABI) выявил скромные успехи в улучшении внимания и рабочей памяти, хотя и омраченные низким качеством исследований, противоречивыми целевыми показателями ЭЭГ и теоретической неясностью. Эти ограничения подчеркнули необходимость хорошо обоснованных, протокол-ориентированных вмешательств, интегрирующих NF с традиционными методами лечения. Особенно актуальны вмешательства, модулирующие низкие бета/SMR диапазоны или подавляющие чрезмерную тета-активность, направленные на сети внимания и сенсомоторные сети, нарушенные при патологии ЦНС.
Цель исследования
Исходя из этих наблюдений, данная серия случаев направлена на изучение возможности и предварительных эффектов интеграции NF, управляемого ЭЭГ, с интенсивной моторной реабилитацией у пациентов, восстанавливающихся после операций по поводу опухолей головного мозга. Конкретно, исследователи стремились оценить: 1) изменения ЭЭГ и клинические (когнитивные, моторные, психологические) показатели после лечения; и 2) корреляции между показателями ЭЭГ и клиническими результатами. Эти предварительные данные предназначены для предоставления начальных доказательств потенциальной роли этого мультимодального подхода в поддержке послеоперационного восстановления у пациентов, перенесших опухоли головного мозга.
Методология исследования
Дизайн и отбор пациентов
Проспективная серия случаев была проведена в отделении нейрореабилитации ICS Maugeri IRCCS (Бари, Италия). Пациенты были отобраны для интенсивной реабилитации после резекции опухоли головного мозга и имели послеоперационные когнитивные нарушения, подтвержденные клиническим нейропсихологическим обследованием. Критерии исключения включали тяжелую афазию, активную эпилепсию, психическую декомпенсацию или неспособность завершить сеансы NF. Были последовательно включены семь пациентов (5 женщин, 2 мужчин; возраст: 46–76 лет). По поступлении в отделение все пациенты прошли стандартные клинические и медицинские обследования, включая послеоперационную нейровизуализацию. В течение первых трех дней участники прошли базовую количественную ЭЭГ (qEEG) запись и комплексное нейропсихологическое обследование.
После базового тестирования пациенты начали вмешательство, которое состояло из 15 сеансов нейрофидбэка (NF) (по 35 минут каждый) пять раз в неделю в течение трех недель, в сочетании с одним часом в день традиционной моторной реабилитации. Моторная реабилитация была направлена в первую очередь на клиническую стабилизацию, постепенную мобилизацию и переход из сидячего положения в вертикальное, с дополнительным акцентом на укрепление мышц нескольких областей, стабилизацию корпуса, восстановление диапазона движений в суставах, тренировку равновесия и подавление спастичности. Функциональные тренировки способствовали независимости в повседневной и инструментальной деятельности.
По окончании вмешательства участники прошли последующее qEEG и повторные нейропсихологические и моторные оценки. Эти послеоперационные оценки проводились в течение 3 дней после последнего сеанса NF, в зависимости от клинического расписания, с целью минимизации влияния немедленных эффектов состояния, но с сохранением краткосрочных нейропластических изменений в подострой фазе реабилитации. Дальнейших наблюдений после выписки из стационара не проводилось.
Запись и обработка ЭЭГ
Записи qEEG в состоянии покоя проводились до и после вмешательства с использованием 21-канальной системы BE PLUS PRO (EBNeuro, Италия). Электроды размещались в соответствии с международной системой 10–20, а сигналы обрабатывались офлайн с помощью NeuroGuide 3.0.6 (Applied Neuroscience Inc., США). Записи визуально проверялись, и артефакты вручную удалялись одним из авторов (BP), сохраняя две минуты данных без артефактов с надежностью раздельного анализа и повторного тестирования ≥ 0.9. Этот порог соответствует установленным процедурам qEEG в клинической практике, где короткие, но высоконадежные выборки в состоянии покоя достаточны для получения стабильных спектральных оценок. Данные без артефактов были сегментированы на 2-секундные эпохи. Быстрое преобразование Фурье (FFT) с окном Ханнинга, реализованное в NeuroGuide, использовалось для измерения ответов в частотной области. Абсолютная спектральная мощность (µV²/Hz) рассчитывалась для каждой эпохи, а затем усреднялась, в то время как относительная мощность выражалась как доля от общей мощности во всех диапазонах.
Для сравнений на уровне группы значения были преобразованы в Z-оценки относительно базы данных нормативных значений для соответствующего возраста, предоставленной в NeuroGuide. Частотные диапазоны определялись как дельта (1–4 Гц), тета (4–8 Гц), альфа (8–12 Гц), бета (12–25 Гц), высокая бета (25–30 Гц), гамма (30–40 Гц) и высокая гамма (40–50 Гц). Также рассчитывались поддиапазоны (например, низкая альфа [8–10 Гц], высокая альфа [10–12 Гц]) и соотношения мощностей (например, Дельта/Альфа, Тета/Бета, Альфа/Высокая Бета) для выявления более тонких спектральных динамик.
Нейропсихологическое обследование
Нейропсихологические обследования проводились до и после вмешательства для оценки изменений в ключевых доменах: глобальная когнитивная функция, память, внимание, исполнительные функции, висцеропространственные способности, речь и настроение. Использовались следующие инструменты: MMSE (Measso et al., 1993) для оценки глобальных когнитивных функций; Rey Auditory Verbal Learning Test (Carlesimo et al., 2013) и Rey–Osterrieth Complex Figure (Caffarra et al., 2002) для вербальной и висцеропространственной памяти; Digit Span (Monaco et al., 2013) и Corsi BlockTapping Test (Fischer, 2001) для кратковременной, рабочей и висцеропространственной памяти; Trail Making Test A и B (Siciliano et al., 2019), Stroop ColorWord Test (Brugnolo et al., 2016), задачи на вербальную беглость (фонематическую и семантическую) (Capitani et al., 1998; Zarino et al., 2014) для оценки внимания и исполнительных функций; Beck Depression Inventory-II (BDIII; Sica et al., 2007) и State-Trait Anxiety Inventory (STAI; Spielberger, 2012) для оценки аффективного состояния. Применялись параллельные формы тестов, где это возможно, для минимизации эффектов практики. Этот комплексный набор тестов позволил детально проанализировать изменения в когнитивно-эмоциональном функционировании, связанные с лечением.
Моторные исходы оценивались на базовом уровне и при выписке с использованием Modified Barthel Index (MBI; Mahoney & Barthel, 1965) и Functional Independence Measure (FIM; Keith et al., 1987). Эти валидированные инструменты оценивают независимость в основных и инструментальных повседневных действиях, предоставляя взаимодополняющие показатели функционального статуса.
Нейрофидбэк-тренинг
Нейрофидбэк-тренинг проводился с использованием оборудования ProComp5 и программного обеспечения Biograph Infiniti (Thought Technology, Монреаль, Канада) в соответствии с установленными методологиями ЭЭГ-биофидбэка (Marzbani et al., 2016). Электроды располагались по международной системе 10–20, с активными выводами на Cz, C3, C4, F3 или FCz в зависимости от локализации поражения и базовых аномалий количественной ЭЭГ (qEEG). Импедансы поддерживались ниже 5 кОм.
Каждый сеанс длился 35 минут и состоял из одного индивидуализированного протокола тренировки, который оставался неизменным для каждого пациента на всех сеансах. Сеансы не разделялись между разными протоколами. Все протоколы включали непрерывное подавление тета- (4–7.5 Гц) и высокобета- (22–26 Гц) активности. Диапазоны вознаграждения подбирались индивидуально: либо низкая бета (13–18 Гц), либо сенсомоторный ритм (SMR; 12–15 Гц). Визуальная и слуховая обратная связь предоставлялась через игровой интерфейс («гонка на лодках»), разработанный для усиления целевой активности мозговых волн.
Пороги не устанавливались автоматически программой; вместо этого они вручную корректировались стажером-психологом в течение каждого сеанса, чтобы поддерживать приблизительно 70% усиления для частот вознаграждения и 20% подавления для нецелевой активности, обеспечивая таким образом соответствующий уровень сложности и вовлеченности пациента. Выбор протокола определялся клиническим профилем, локализацией поражения и результатами qEEG в состоянии покоя. Пациенты 1–4, у которых наблюдалась избыточная активность медленных волн в лобных или центральных областях наряду с нарушениями внимания или исполнительных функций, получали протокол тета/бета, вознаграждающий низкую бета-активность при подавлении тета- и высокобета-активности. Пациенты 5–7, у которых были затронуты сенсомоторные пути или наблюдались нарушения регуляции возбуждения, получали протокол SMR/тета, вознаграждающий SMR при подавлении тета- и высокобета-активности. Протокол SMR также использовался у пациентов с повышенным риском эпилептиформной активности, учитывая его стабилизирующее влияние на таламокортикальные сети.
Выбранные протоколы являются стандартизированными модулями, включенными в программное обеспечение Biograph Infiniti, и отражают широко используемые подходы в клиническом нейрофидбэке. Перед первым сеансом NF участники получали стандартное объяснение процедуры от стажера-психолога. Их информировали о значении визуальной и слуховой обратной связи и побуждали оставаться внимательными и вовлеченными на протяжении всего сеанса. Явные когнитивные стратегии не предписывались, в соответствии с намерением позволить участникам спонтанно находить подходы к саморегуляции. Чтобы избежать потенциального загрязнения сигналов ЭЭГ, участникам рекомендовалось не выполнять преднамеренные физические движения или явные умственные задачи, такие как счет. Индивидуальные стратегии, применяемые пациентами, систематически не регистрировались, что мы признаем как методологическое ограничение. Хотя наше исследование является серией случаев, а не рандомизированным контролируемым исследованием, мы сообщаем об этих элементах в соответствии с текущими рекомендациями по прозрачности методологии нейрофидбэка.
Эта индивидуализированная структура была разработана для поддержки целенаправленной саморегуляции кортикальных ритмов, одновременно активируя механизмы геббовской и гомеостатической пластичности, которые, как полагают, лежат в основе нейрофизиологических и функциональных улучшений, индуцированных NF.
Статистический анализ
Проведен количественный анализ для оценки изменений в нейрофизиологических и поведенческих показателях у семи пациентов. Основное внимание уделялось выявлению индивидуальных и межгрупповых закономерностей изменений с учетом гетерогенности, типичной для дизайна серии случаев. Z-оценки данных ЭЭГ были извлечены как для абсолютной мощности, так и для соотношений мощностей из базовых и послеоперационных оценок. Для всех анализов значения мощности диапазона и соотношения мощностей были получены с активного электродного сайта, указанного в таблице 1 (Локация вмешательства). Анализировалась абсолютная мощность в пяти частотных диапазонах: Дельта, Тета, Альфа, Бета и Высокая Бета. Рассматривались соотношения мощностей Дельта/Бета, Тета/Бета и Альфа/Высокая Бета, поскольку они коррелируют с когнитивными и моторными функциями. Для каждого пациента рассчитывались изменения (после минус до) для количественной оценки внутрисубъектных сдвигов в нейронной активности. Описательные визуализации, включая тепловые карты, использовались для иллюстрации индивидуальных траекторий и выделения вариабельности между пациентами.
Для определения статистической значимости изменений в индивидуальных показателях теста рассчитывался Индекс Надежных Изменений (RCI) для каждого пациента и каждого показателя результата, как описано Hammers & Duff (2021). RCI оценивает, превышает ли наблюдаемое изменение то, что можно ожидать от ошибки измерения или нормальной вариабельности при повторном тестировании. Он рассчитывается по формуле: RCI = (X_после – X_до) / SE_diff где SE_diff = √2 × SD × √(1 – r). В этой формуле X_до и X_после представляют собой показатели пациента до и после вмешательства, SD — стандартное отклонение теста в нормативной популяции, а r — коэффициент надежности повторного тестирования. Стандартная ошибка разницы (SE_diff) количественно определяет ожидаемую вариабельность из-за ошибки измерения. По общепринятому соглашению, RCI > 1.96 интерпретировался как надежное улучшение, тогда как значения < –1.96 указывали на надежное ухудшение (p < 0.05). Значение r ≥ 0.6 считалось высоким. Коррекции на множественные сравнения не применялись из-за исследовательского характера и ограниченного размера выборки этой серии случаев.
Результаты
Изменения абсолютной мощности ЭЭГ (Z-оценка)
Z-оценки изменений абсолютной мощности ЭЭГ анализировались по пяти частотным диапазонам (Дельта, Тета, Альфа, Бета и Высокая Бета) для всех семи пациентов (Рис. 3; Дополнительная таблица 1). Эти ΔZ отражают, насколько послеоперационная мощность сместилась в сторону или от среднего нормативного значения (Z = 0). В соответствии с устоявшимися конвенциями qEEG, значения |Z|≥ 2 считаются клинически значимыми отклонениями от нормативного референса. Пациент 1 продемонстрировал наиболее выраженные изменения, с большими снижениями во всех диапазонах, включая Дельта (ΔZ = –4.69, значительно превышая порог |Z|≥ 2) и Тета (ΔZ = –1.06), а также меньшие снижения в Альфа, Бета и Высокой Бета. Это широко распространенное снижение предполагает нормализацию диффузной кортикальной гиперактивности.
Пациент 2 показал более мягкую модуляцию, включая снижение на 0.89 пункта в Дельта и небольшое увеличение в Альфа и Бета (все в пределах |Z|< 2), что соответствует более умеренной спектральной нормализации. Пациент 3 продемонстрировал избирательное снижение Тета (ΔZ = –1.08), все еще в пределах нормы, но с направленностью, соответствующей улучшению регуляции внимания. Пациент 4 показал небольшие снижения в большинстве диапазонов (наибольший ΔZ = –0.67 в Дельта), указывая на относительную спектральную стабильность. Пациент 5 показал умеренное увеличение в Альфа (+0.38) и Бета (+0.35), оставаясь в пределах нормативных значений, возможно, отражая усиление возбуждения.
Более сложные паттерны наблюдались у Пациентов 6 и 7. Пациент 6 продемонстрировал умеренное снижение в Тета (ΔZ = –1.09) и значительное подавление Альфа (ΔZ = –2.65, аномальное), возможно, отражающее чрезмерную модуляцию кортикального торможения. Пациент 7 показал многодиапазонное снижение в Дельта (ΔZ = –0.63), Тета (ΔZ = –2.06, аномальное), Альфа (ΔZ = –1.97, пограничное) и Бета (ΔZ = –1.17), в сочетании со значительным увеличением Высокой Бета (ΔZ = +1.97). Эти сдвиги указывают на динамическую реконфигурацию осцилляторного баланса, с нормализацией и возможной дез-регуляцией. В целом, все пациенты показали измеримые изменения, но степень клинической значимости варьировалась: Пациенты 1, 6 и 7 продемонстрировали сдвиги за пределами |Z|≥ 2, в то время как другие показали более тонкие модуляции в пределах нормативных диапазонов.
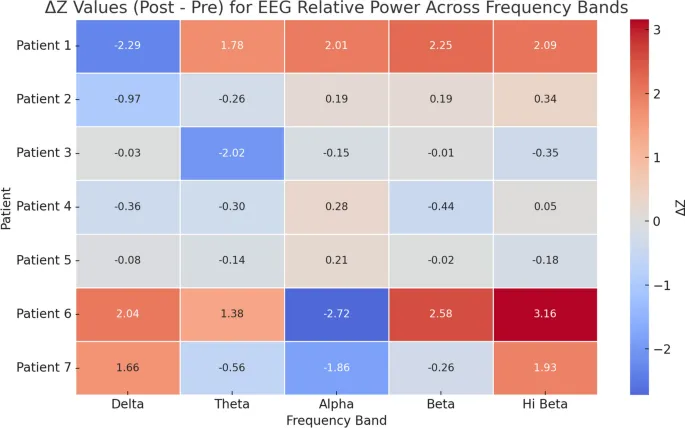
Изменения относительной мощности ЭЭГ (Z-оценка)
Анализ Z-оценки относительной мощности ЭЭГ (Рисунок 5) показал, что Пациент 1 демонстрировал наиболее выраженную активацию с увеличением во всех диапазонах, включая значительные изменения в Дельта (–2.29), Альфа (+2.01), Бета (+2.25) и Высокая Бета (+2.09). Пациент 6 показал четкий профиль с большими увеличениями в Бета (+2.58) и Высокая Бета (+3.16), и резким снижением Альфа (–2.72), указывая на повышенное возбуждение. Пациент 3 показал снижение, наиболее заметное в Тета (–2.02), предполагая снижение внутреннего фокуса. Пациенты 2, 4 и 5 показали минимальные сдвиги, все в пределах нормативных значений (|ΔZ| < 2). Пациент 7 имел смешанные результаты с увеличением Дельта (+1.66) и Высокая Бета (+1.93), и пограничным снижением Альфа (–1.86).
В целом, клинически значимые изменения были наиболее выражены у Пациентов 1 и 6, отражая высокую индивидуальную вариабельность модуляции ЭЭГ после NF-тренинга.
Изменения соотношения мощностей ЭЭГ (Z-оценка)
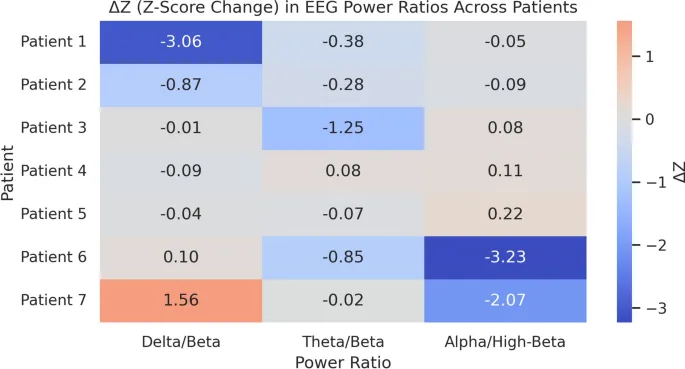
Z-оценки соотношений мощностей ЭЭГ анализировались для Дельта/Бета, Тета/Бета и Альфа/Высокая Бета у всех семи пациентов (Рис. 4; Дополнительная таблица 2). Соотношения интерпретируются как маркеры кортикального возбуждения (Дельта/Бета), регуляции внимания (Тета/Бета) и аффективной/эмоциональной обработки (Альфа/Высокая Бета). Как и в случае с абсолютной мощностью, |Z|≥ 2 использовался в качестве стандартного порога для клинической значимости.
Пациент 1 продемонстрировал наиболее выраженное улучшение с ΔZ –3.06 в Дельта/Бета, что отражает нормализацию от заметно аномального базового уровня. Меньшие изменения произошли в Тета/Бета (–0.38) и Альфа/Высокая Бета (–0.05), оба в пределах нормативных значений. Пациент 2 продемонстрировал аналогичное, хотя и менее выраженное улучшение, со снижением в Дельта/Бета (–0.87) и Тета/Бета (–0.28), все в пределах |Z|< 2. Пациент 3 показал незначительные изменения в Дельта/Бета, но снижение в Тета/Бета (–1.25), предполагая модуляцию внимания, хотя и не клинически аномальную. Альфа/Высокая Бета оставалась стабильной (+0.08). Пациент 4 имел минимальные изменения во всех соотношениях, все в пределах нормального диапазона. Пациент 5 показал аналогичные небольшие сдвиги (ΔZ ≤|0.22|).
Пациенты 6 и 7 продемонстрировали нетипичные профили. Пациент 6 показал большое снижение в Альфа/Высокая Бета (ΔZ = –3.23, аномальное), наряду с меньшими сдвигами в Дельта/Бета (+0.10) и Тета/Бета (–0.85). Пациент 7 продемонстрировал увеличение Дельта/Бета (+1.56, пограничное аномальное) и снижение Альфа/Высокая Бета (–2.07, аномальное), указывая на потенциальную дез-регуляцию в аффективных цепях. В совокупности нормализация за пределами |Z|≥ 2 была наиболее очевидна у Пациентов 1 и 2, в то время как Пациенты 6 и 7 показали аномальные сдвиги в Альфа/Высокая Бета. Эта гетерогенность подчеркивает как потенциальные преимущества, так и риски индивидуализированного NF, подчеркивая необходимость более крупных, контролируемых исследований для уточнения функционального значения изменений соотношений.
Когнитивные и функциональные показатели
Анализ Индекса Надежных Изменений (RCI) показал, что у нескольких пациентов наблюдались статистически значимые улучшения после вмешательства.
- Пациент 1 продемонстрировал надежные успехи в вербальной беглости (фонематическая беглость RCI = 2.22; семантическая беглость RCI = 3.89), памяти (RWL Immediate Recall RCI = 2.48; Rey Figure Delayed RCI = 2.64), моторной функции (FIM RCI = 22.63; BIM RCI = 10.53) и глобальной когнитивной функции (MMSE RCI = 3.05). Примечательно, что у этого пациента также наблюдались улучшения в аффективном функционировании (BDIII RCI = –3.29; STAI1 RCI = –2.25), что указывает на снижение депрессивных симптомов и симптомов тревоги.
- Пациент 2 показал широкие улучшения в внимании и исполнительных функциях (Stroop Errors RCI = –3.36; Stroop Time RCI = –21.31; Phonemic Fluency RCI = 6.11; Semantic Fluency RCI = 7.78; Backward Digit Span RCI = 2.61), памяти (RWL Immediate RCI = 2.94; Delayed RCI = 2.12), висцеропространственных способностях (Clock Drawing Test RCI = 3.02), моторной функции (FIM RCI = 13.08; BIM RCI = 8.80), аффективных симптомах (BDIII RCI = –3.70) и глобальной когнитивной функции (MMSE RCI = 5.33).
- Пациент 3 также показал существенные улучшения в внимании (Phonemic Fluency RCI = 5.83; Digit Span RCI = 4.47), висцеропространственной деятельности (Clock Drawing RCI = 3.02), аффективной регуляции (BDIII RCI = –2.06; STAI1 RCI = –8.57) и моторной функции (FIM RCI = 17.32; BIM RCI = 4.09).
- Пациент 4 улучшил показатели вербальной беглости (Phonemic Fluency RCI = 2.5), аффективного функционирования (BDIII RCI = –3.70; STAI1 RCI = –3.88), моторных способностей (FIM RCI = 5.3) и общей когнитивной функции (MMSE RCI = 2.28).
- Пациент 5 продемонстрировал надежные улучшения в различных доменах, включая внимание и рабочую память (Stroop Errors RCI = –3.61; Digit Span RCI = 5.96; Backward Digit Span RCI = 5.22), память (RWL Immediate RCI = 2.94), висцеропространственные способности (Clock Drawing RCI = 3.77), моторную функцию (FIM RCI = 16.62; BIM RCI = 7.23) и когнитивные функции (MMSE RCI = 6.85).
- Пациент 6 улучшил показатели вербальной беглости (Phonemic Fluency RCI = 3.06; Semantic Fluency RCI = 6.01), памяти (RWL Immediate RCI = 2.26; Rey Figure Delayed RCI = 2.64), моторной деятельности (FIM RCI = 13.08; BIM RCI = 10.53) и общей когнитивной функции (MMSE RCI = 2.28). У этого пациента также произошло надежное снижение депрессивных симптомов (BDIII RCI = –2.47).
- Пациент 7 показал надежные улучшения в вербальной и рабочей памяти (Phonemic Fluency RCI = 3.33; Digit Span RCI = 2.98; RWL Immediate RCI = 2.94), висцеропространственной обработке (Clock Drawing RCI = 3.77), аффективном функционировании (BDIII RCI = –4.52), моторной функции (FIM RCI = 4.95) и общей когнитивной функции (MMSE RCI = 2.28).
Эти результаты RCI подтверждают, что улучшения были не только широко распространены среди пациентов и в различных доменах, но и соответствовали клинически значимым достижениям.
Результаты корреляционного анализа
Исследовательский корреляционный анализ Спирмена выявил сильную отрицательную статистически значимую корреляцию между ΔDelta/Beta и ΔRWL_D (ρ = –0.83, p = 0.02), предполагая, что увеличение активности медленных волн по сравнению с бета-частотами связано со снижением производительности отсроченного вербального воспроизведения (см. Таблицу 2).
Обсуждение
Данное исследование изучало комбинированные эффекты интенсивного нейрофидбэк-тренинга и моторной реабилитации в клинически гетерогенной группе пациентов после нейрохирургических операций. Результаты выявили многомерные изменения в нейрофизиологических и клинических доменах, предполагая, что qEEG-управляемый NF может служить вспомогательным дополнением к постоперационным траекториям восстановления, как было предложено в предыдущих пилотных исследованиях с участием пациентов после инсульта и черепно-мозговой травмы.
На нейрофизиологическом уровне Z-оценки изменений абсолютной мощности ЭЭГ выявили различную модуляцию в частотных диапазонах и у отдельных пациентов. Пациент 1 продемонстрировал большие снижения мощности во всех диапазонах (Дельта, Тета, Альфа, Бета и Высокая Бета) (ΔZ < –1.0), предполагая широкую нормализацию изначально повышенной спектральной активности по сравнению с нормативными базовыми уровнями ЭЭГ. Этот паттерн согласуется со снижением диффузной кортикальной дез-регуляции и может отражать улучшение целостности сети после вмешательства. Пациенты 2 и 5 показали небольшие увеличения мощности Альфа и Бета (ΔZ < +0.5), изменения, которые могут соответствовать легкой степени улучшения регуляции возбуждения или когнитивной вовлеченности.
Другие пациенты, включая Пациентов 3, 4, 6 и 7, продемонстрировали более тонкие или сложные сдвиги. Например, Пациент 6 показал значительное подавление Альфа (ΔZ = –2.65), в то время как Пациент 7 продемонстрировал широкие снижения в диапазонах Дельта, Тета, Альфа и Бета, в сочетании с увеличением Высокой Бета. В совокупности эти результаты свидетельствуют о том, что изменения абсолютной мощности ЭЭГ, выраженные через Z-нормализацию, присутствовали у всех пациентов, но значительно различались по величине, направлению и, вероятно, функциональному воздействию. Хотя относительная мощность часто считается предпочтительной для сравнений на групповом уровне или между регионами, в настоящем дизайне, сфокусированном на поражении и внутрисубъектном, значения абсолютной мощности предоставляли клинически значимую информацию о локальных спектральных изменениях. Кроме того, выражая результаты как Z-оценки относительно нормативной базы данных для соответствующего возраста, мы снизили индивидуальную вариабельность проводимости и анатомии, которая обычно мотивирует использование относительных метрик. Относительная мощность, хотя и полезна в более широких популяционных исследованиях, может математически скрывать локальные аномалии, перераспределяя изменения между диапазонами как пропорции от общей мощности. Таким образом, абсолютная мощность с Z-нормализацией была наиболее подходящим выбором для этого дизайна серии случаев, сохраняя величину и направление перилезионных изменений.
Анализ соотношений мощностей ЭЭГ дал дальнейшее представление. Снижение соотношений Дельта/Бета и Тета/Бета, особенно у Пациентов 1 и 2, обычно интерпретируется как маркеры улучшенной кортикальной активации, регуляции внимания и нейрокогнитивной готовности. Например, Пациент 1 продемонстрировал значительное снижение Z-оценки Дельта/Бета более чем на 3 стандартных отклонения, отражающее переход от крайне аномального диапазона к нормативным значениям. Пациент 2 показал аналогичные, хотя и менее выраженные, улучшения. Другие пациенты, включая Пациентов 3, 4 и 5, продемонстрировали незначительные изменения, причем послеоперационные значения в основном находились в пределах нормативных диапазонов. Более расходящиеся паттерны наблюдались у Пациентов 6 и 7: Пациент 6 показал большое снижение соотношения Альфа/Высокая Бета (ΔZ = –3.23), в то время как Пациент 7 продемонстрировал увеличение Дельта/Бета (ΔZ = +1.56) и значительное снижение Альфа/Высокая Бета (ΔZ = –2.7), предполагая потенциальную гиперактивацию или аффективную дез-регуляцию. Эти результаты подчеркивают как потенциальную полезность, так и ограничения метрик соотношений ЭЭГ в качестве последовательных маркеров изменений, особенно в гетерогенных клинических выборках.
Важно отметить, что нейрофизиологические изменения совпали с поведенческими улучшениями во многих, но не во всех случаях. Анализ Индекса Надежных Изменений (RCI) показал, что все семь пациентов продемонстрировали надежные улучшения в когнитивных, аффективных и моторных доменах, хотя величина и широта улучшений варьировались. Пациент 1, который продемонстрировал наиболее выраженные изменения ЭЭГ, также достиг существенных улучшений в вербальной беглости, памяти, настроении и общей когнитивной функции. Пациент 2 показал значительные поведенческие улучшения в исполнительных функциях, памяти и функциональной независимости, в соответствии с умеренной нормализацией ЭЭГ. Однако эта закономерность не была универсальной. Пациент 5, у которого наблюдались лишь незначительные сдвиги в соотношении ЭЭГ и умеренные спектральные изменения, тем не менее, показал надежные улучшения в нескольких поведенческих доменах. Пациент 4, несмотря на ограниченные изменения ЭЭГ, продемонстрировал улучшения в речи, аффективном функционировании и общей когнитивной функции. Пациенты 6 и 7 продемонстрировали значительные нейрофизиологические изменения и надежные поведенческие улучшения, хотя паттерны ЭЭГ были менее четко связаны с направленностью поведенческого ответа. Эти примеры предполагают, что, хотя нейрофизиологические и поведенческие изменения часто совпадают, их взаимосвязь сложна и, вероятно, модулируется такими факторами, как характеристики поражения, базовый уровень функции или вовлеченность в терапию.
Примечательно, что исследовательский корреляционный анализ выявил значимую отрицательную связь между изменениями соотношения Дельта/Бета и производительностью отсроченного вербального воспроизведения (ρ = –0.83, p = 0.02), указывая на то, что большее снижение доминирования медленных волн было связано с большими улучшениями в эпизодической памяти. Это наблюдение дает предварительную поддержку роли соотношений ЭЭГ как потенциальных биомаркеров когнитивного восстановления, особенно в доменах, чувствительных к целостности фронтотемпоральной сети. Однако это наблюдение следует интерпретировать с осторожностью, учитывая небольшой размер выборки и исследовательский характер анализа.
Во время задач на вербальное обучение и воспроизведение, таких как Rey Auditory Verbal Learning Test (RAVLT), наблюдаются характерные изменения ритмов ЭЭГ. В частности, синхронизация альфа- и бета-ритмов последовательно связана с активным кодированием памяти, контролем внимания и обработкой информации. И наоборот, снижение мощности дельта-ритмов связано со снижением восприимчивости к помехам и улучшением производительности при воспроизведении. Эти данные предполагают, что динамический баланс между низкочастотной (дельта) и высокочастотной (бета) активностью поддерживает эффективную вербальную память. Однако конкретное соотношение дельта/бета не было надежно установлено как прямой нейрофизиологический маркер вербальной памяти.
Интеграция данных ЭЭГ и поведенческих данных через визуальную матрицу (Рис. 5) проиллюстрировала как сходящиеся, так и расходящиеся паттерны ответа. Пациенты с наиболее выраженными нейрофизиологическими изменениями (например, Пациент 1) обычно достигали больших клинических успехов, в то время как пациенты с более умеренной модуляцией ЭЭГ имели переменные исходы. Это предполагает, что биомаркеры ЭЭГ могут быть полезны не только для отслеживания результатов, но и для выявления вероятных респондеров на NF-усиленные вмешательства — направление, которое все больше исследуется в прогнозном моделировании ЭЭГ для нейрореабилитации. По сравнению со стандартной реабилитацией, добавление NF может предложить уникальные преимущества путем модуляции неявной нейронной динамики и обеспечения добровольной саморегуляции кортикальной активности. Предыдущие исследования показали, что NF может влиять на крупномасштабные сети мозга, такие как сети значимости и сети режима по умолчанию, поддерживая его роль в содействии адаптивной нейропластичности. Хотя данное исследование не оценивало связность напрямую, эти механистические гипотезы остаются правдоподобными и заслуживают будущего исследования.
Ограничения исследования:
- Небольшая выборка и отсутствие контрольной группы: Это ограничивает возможность делать причинно-следственные выводы и обобщать результаты.
- Клиническая гетерогенность: Различия в локализации поражения, базовом состоянии и реакции на лечение затрудняют интерпретацию.
- Интенсивность протокола NF: Высокая интенсивность может быть непосильной для более ослабленных пациентов.
- Потенциальные конфаундеры: Эффекты медикаментов, усталость и приверженность лечению не могли быть полностью контролированы.
- Неполное отражение динамики сети: Z-оценки ЭЭГ могут не полностью отражать сетевые процессы, лежащие в основе восстановления.
- Отсутствие систематического мониторинга стратегий пациентов: Неизвестность когнитивных стратегий и эффективности обучения NF затрудняет интерпретацию.
Несмотря на эти ограничения, исследование является одним из первых, применивших NF в сочетании с интенсивной моторной реабилитацией у пациентов после операций по поводу опухолей головного мозга. Интеграция нейрофизиологических, когнитивных и функциональных показателей дает многомерную перспективу на эффекты лечения, а использование стандартизированных метрик ЭЭГ улучшает сопоставимость с другими клиническими группами. Важно, что исследование проводилось в реальных условиях стационарной реабилитации, подчеркивая возможность внедрения протоколов NF в рутинную клиническую практику. Таким образом, эти предварительные результаты создают ценную основу для будущих контролируемых исследований, направленных на подтверждение эффективности и выяснение механизмов NF-опосредованного восстановления в нейроонкологии.
Будущие исследования должны быть направлены на воспроизведение и расширение этих предварительных результатов в более крупных, контролируемых когортах с детализированными подгруппами и более длительным наблюдением. Включение анализа локализации источника ЭЭГ и показателей функциональной связности может помочь прояснить лежащие в основе механизмы, в то время как адаптация целей NF к индивидуальным профилям ЭЭГ может повысить точность протокола. Интеграция NF с когнитивными и аффективными реабилитационными стратегиями может быть особенно полезна для пациентов с фронтолимбическим поражением, где саморегуляция кортикальных ритмов может способствовать функциональному восстановлению в конкретных доменах.
Заключение
Данная серия случаев предоставляет предварительные доказательства, подтверждающие возможность и потенциальную полезность сочетания нейрофидбэка с интенсивной моторной реабилитацией у пациентов, восстанавливающихся после операций по поводу опухолей головного мозга. Интеграция нейрофизиологических и поведенческих данных выявила частично сходящиеся траектории кортикальной реорганизации и функционального улучшения, особенно в доменах, связанных с вниманием, памятью и исполнительными функциями. Несмотря на очевидную индивидуальную вариабельность, направленность и величина Z-нормализации ЭЭГ — особенно в соотношениях мощности, таких как Дельта/Бета — часто совпадали со значимыми клиническими улучшениями. Хотя методологические ограничения, включая небольшой размер выборки и отсутствие контрольной группы, ограничивают причинно-следственную интерпретацию, наблюдаемые паттерны предполагают, что нейрофидбэк может служить ценным нейромодуляторным дополнением в нейроонкологической реабилитации. Будущие контролируемые исследования с детализированными выборками и расширенным наблюдением необходимы для воспроизведения этих результатов, уточнения механизмов и оптимизации персонализированных стратегий вмешательства, основанных на ЭЭГ.